Растворимость веществ. Факторы, влияющие на растворимость веществ.
Количественной характеристикой соотношения компонентов насыщенного раствора является растворимость. Наиболее распространенными способами такой характеристики служат:
· коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре раствориться в 100 г растворителя. Например, при 20ْ С в 100 г воды с образованием насыщенного раствора растворяется 36,0 г NaCI, значит Р(NaCI) = 36.
Способы выражения концентрации растворов. Способы выражения состава растворов.
Состав растворов количественно принято выражать через безразмерные количественные величины – доли (массовую, объемную, молярную) и размерные величины – концентрации.
1. Массовая доля (W) или процентная концентрация - отношение массы растворенного вещества к массе раствора.
Массовая доля – безразмерная величина, ее выражают в долях от единицы в процентах (10%). Массовая доля показывает, сколько граммов данного вещества, находится в 100 г раствора
Пример:
W (NaOH) = 5% или 0,05 означает, что
5 г NaOH находится в 100г раствора,
5 г NaOH находится в 95 г воды,
то есть, чтобы приготовить 5% раствор NaOH нужно взять 5 гр. NaOH и 95 гр (мл) воды.
2. Объемная доля j - отношение объема растворенного вещества к объему всего раствора.
V(A) - объем растворённого вещества А
V р-ра - объём раствора
j(А) = V(А): Vр-ра
3. Мольная доля N – отношение молей растворенного вещества к сумме числа молей всех веществ, составляющих раствор.
Пример: раствор состоит из растворителя А и растворённых веществ В, С, Д. Они смешаны в молях n. Тогда мольная доля N вещества В равна
N(В) = nВ: (nА + nВ + nС + nД)
4. Молярная концентрация (молярность) См (моль/л) – показывает число молей растворенного вещества в одном литре раствора, выражается отношением количества растворенного вещества к объему раствора.
Например: Нужно приготовить 2М раствор серной кислоты.H2SO4
Находим количество грамм H2SO4, которое нужно растворить.
По табл. Менделеева вычисляем атомную массу серной кислоты Ма
Ма H2SO4 – 98 г.
2 моля H2SO4 весят 2 х 98 =196 г
Чтобы приготовить раствор, нужно взять мерную колбу на 1 литр, наполнить дистиллированной водой до половины и медленно присыпать, постоянно помешивая, 196 г. H2SO4 до полного растворения. Затем довести раствор дистиллированной водой до метки.
Для обозначения молярной концентрации применяются символы:
1М-одномолярный раствор См = 1 моль/л
0,1М-децимолярный раствор См = 0,1 моль/л
2М двухмолярный раствор. и т. д.
5. Нормальная концентрация (нормальность раствора) или молярная концентрация эквивалента, Сн (экв/л) –показывает отношение числа эквивалентов растворенного вещества к объему раствора в литрах.
Сн = n экв.a: V р-ра
Сн - нормальная концентрация [моль/л]
1Н - однонормальный раствор Сн =1 моль/л
0,1Н - децинормальный раствор Сн=0,1 моль/л
0,01Н - сантинормальный раствор Сн = 0,01 моль/л
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов H водорода или замещает то же его количество в химических реакциях.
Например, в соединениях HCl, H2S, NH3, CH4 эквивалент хлора, серы, азота, углерода равен соответственно 1 моль, ½ моль, 1/3 моль, ¼ моль
Значит эквивалентные массы перечисленных выше веществ равны:
34,45 г/моль, 32/2 = 16 г/моль, 14/3 = 4,67 г/моль, 12/4 = 3 г/моль
Значение 1 моля соединения – величина постоянная, а грамм-эквивалент одного и того же вещества не является величиной постоянной, так как определяется той реакцией, в которой участвует это вещество. Например, взаимодействие серной кислоты со щелочью может идти так:
H2SO4+KOH=KHSO4+H2O
или
H2SO4+2KOH=K2SO4+2H2O
В первой реакции 1 молекула кислоты реагирует с 1 молекулой NaOH, т.е. 1 молекула кислоты эквивалента 1 эквиваленту водорода или 1 эквиваленту щелочи. Поэтому эквивалент H2SO4 равен ее молекулярной массе:
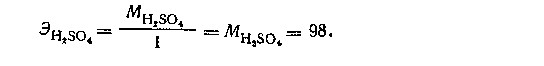
Грамм-эквивалент H2SO4 в этой реакции равен 98г.
Во второй реакции 1 молекула кислоты соответствует 2 эквивалентам водорода (или 2 эквивалентам щелочи). Поэтому,
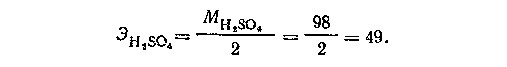
Грамм-эквивалент H2SO4 в этой реакции равен 49г.
Очевидно, для нахождения грамм-эквивалента того или иного вещества в данной реакции нужно составить уравнение реакции и затем рассчитать значение грамм-эквивалента.
6. Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльная концентрация (моляльность,[5] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
mB= nB/mA,
где:
· nB— количество растворённого вещества, моль;
· mA — масса растворителя, кг.
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.