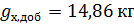1. 2 кг раствора C2H5OH – CCl4 состава 30 мол. % CCl4 подвергается перегонке. Сколько граммов и какого компонента можно выделить в чистом виде при разгонке этой смеси?
За компонент «э» примем этанол, за компонент «х» - тетрахлорметан. Величины без индекса соответствуют характеризуют всю систему. Индекс «аз» говорит о том, что величина относится к азеотропной смеси.
Найдём в справочнике диаграмму состояния системы C2H5OH – CCl4 (табл. 28)
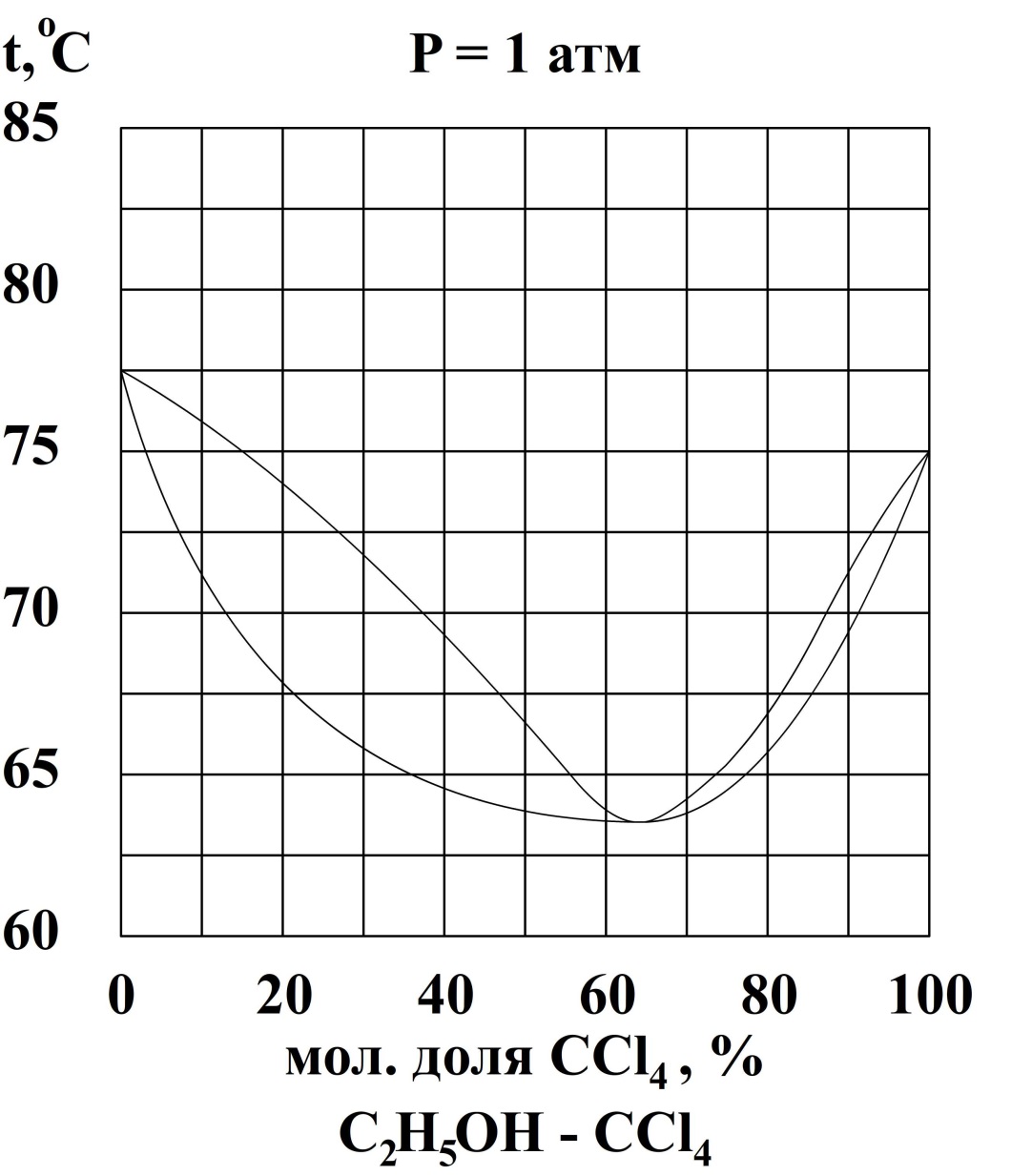
Поскольку систему с азеотропной точкой можно разделить только на один чистый компонент и смесь азеотропного состава, определим с какой стороны от азеотропной смеси находится представленная в условии.
Азеотропная смесь содержит ~64% мол. тетрахлорметана. Соответственно смесь состава 30% мол. тетрахлорметана лежит между азеотропной смесью и чистым этанолом. Таким образом, при разделении этой смеси можно получить некоторое количество чистого этанола и нельзя выделить чистый тетрахлорметан.
Определим состав исходной смеси:
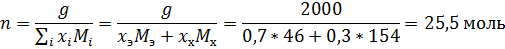
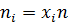
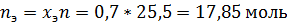
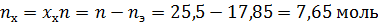
Поскольку в чистом виде тетрахлорметан не выделяется – он весь останется в азеотропе, связав некоторое количество этанола.
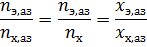
Обратите внимание, 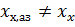
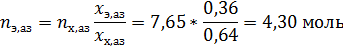
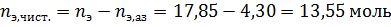
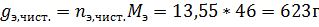
Ответ: 623 г чистого этанола.
2. К 20 кг раствора, содержащего 25 мол. % CH3COOH добавили 10 кг раствора, содержащего 40 масс. % Н2О. При какой температуре начнёт кипеть полученный раствор?
За компонент «у» примем уксусную кислоту, за компонент «в» - воду. Величины без индекса соответствуют характеризуют всю систему. За раствор «1» примем первый раствор, за «2» второй, за «3» - конечный.
Сначала рассчитаем состав конечного раствора.
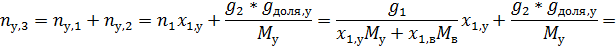
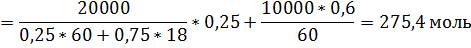
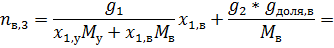
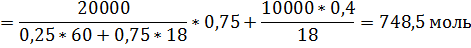
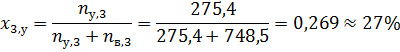
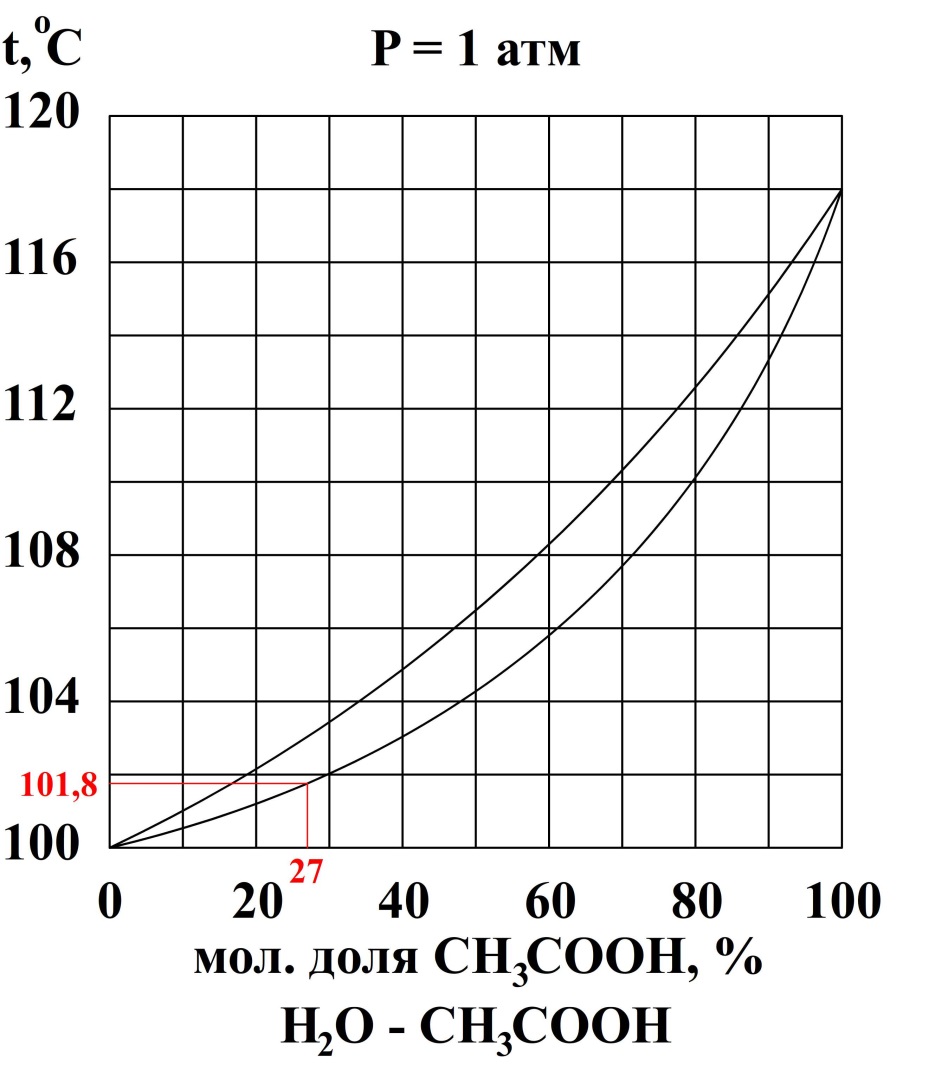
Ответ: tнач. кип = 101,8 ⁰С.
3. Пользуясь диаграммой H2O – HNO3, рассчитайте массу азотной кислоты, которая будет находиться в жидкой фазе, если 2,0 кг раствора, содержащего 20 мол. % H2O нагреть до 100 ºС.
За компонент «а» примем азотную кислоту, за компонент «в» - воду. Величины без индекса соответствуют характеризуют всю систему. Индексом «ж» обозначим свойства жидкой фазы, индексом «п» - паровой, без индекса – свойства всей системы.
По диаграмме кипения найдём равновесные концентрации азотной кислоты в жидкой и паровых фазах.
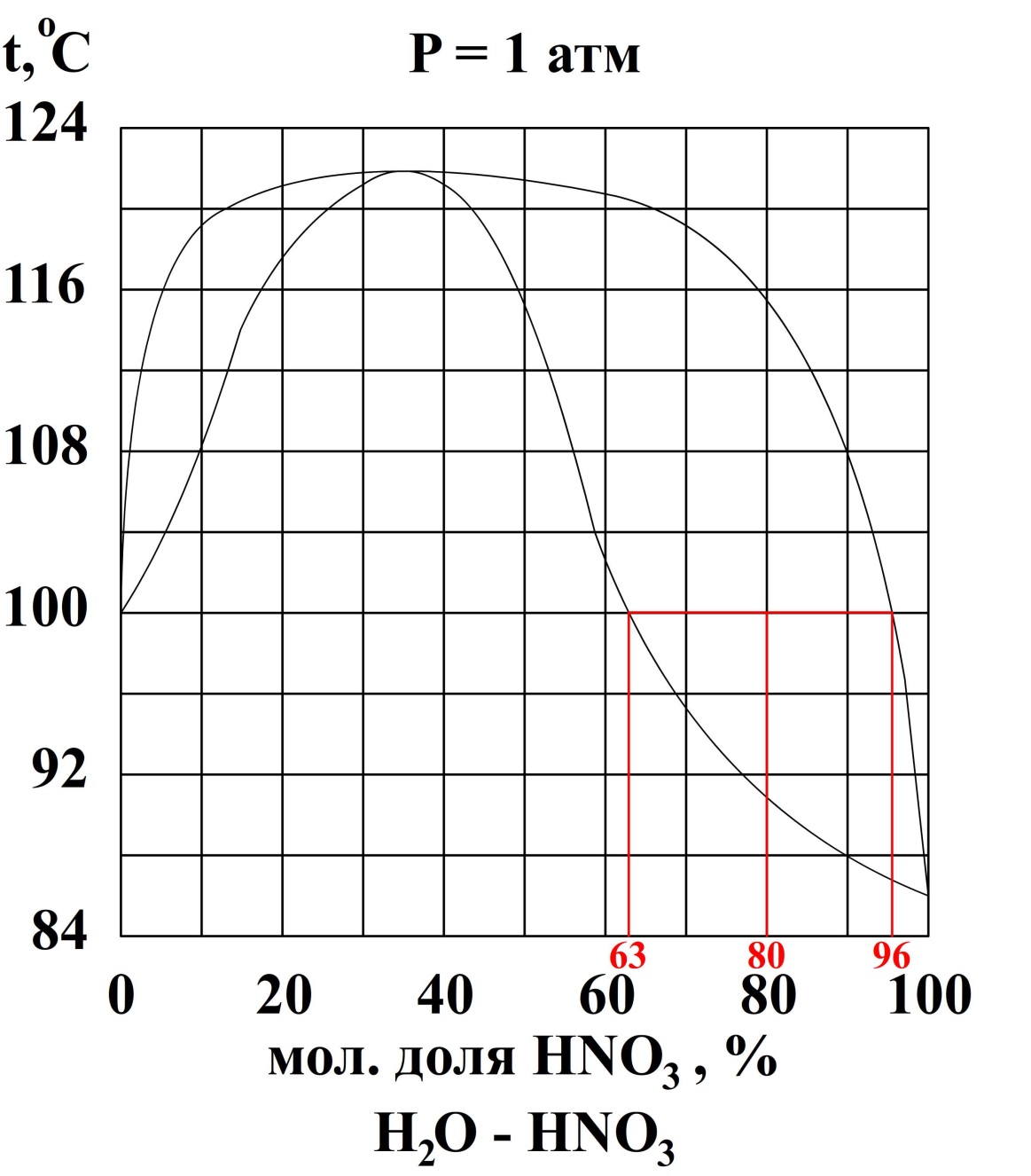
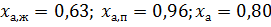
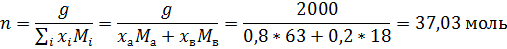
По правилу рычага:
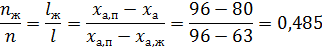
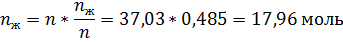
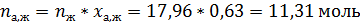
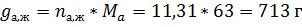
Ответ: 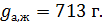
4. Пользуясь диаграммой кипения системы C2H5OH – CCl4, определите количество этилового спирта (в молях) в паровой фазе, если 10 кг жидкой смеси, содержащей 20 мол. % CCl4, нагреть до 70 ºС.
Для самостоятельного решения
Ответ: 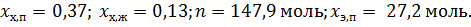
5. Определите какое минимальное количество и какого компонента необходимо добавить к 10 кг раствора состава 25 мол. % CCl4 - 75 мол. % C2H5OH, находящихся при температуре 65 ºС, для того чтобы перевести систему в полностью газовое состояние.
За компонент «э» примем этанол, за компонент «х» - тетрахлорметан. Величины без индекса соответствуют характеризуют всю систему. Индекс «н» говорит о том, что величина относится к начальной системе, а индекс «к» - к конечной.
Для того чтобы система перешла в полностью паровое состояние без изменения температуры при минимальном добавлении какого-либо вещества, нужно привести её состав к составу соответствующему линии пара.
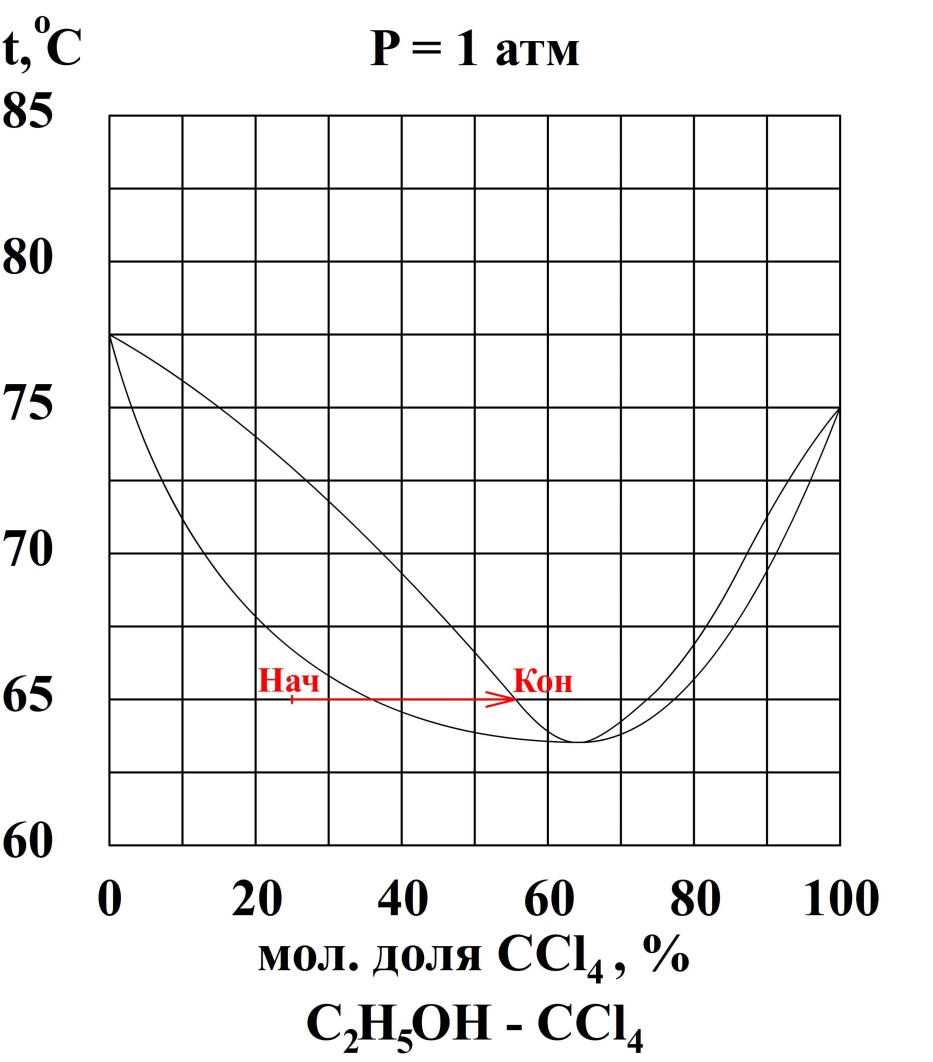
После этого с точки зрения физической химии задача решена, нужно только рассчитать состав начальной и конечной системы, а также их разницу.
Необходимо добавлять тетрахлорметан, следовательно количество этанола не изменится.
По диаграмме найдём конечный состав системы: 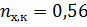
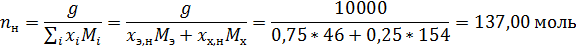
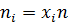
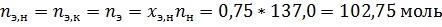
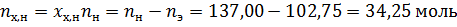
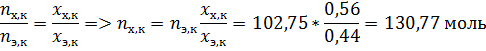
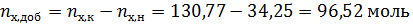
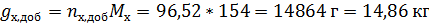
Ответ: