Дисциплина: Химия
Раздел 3. Растворы
Учебное задание № 7 «Расчет параметров и приготовление раствора заданной концентрации»
Лабораторная работа № 6 «Приготовление раствора карбоната натрия с заданной концентрацией методом разбавления»
Этап индивидуальной работы
1. Разместите структурированную информацию (результат работы с информационными источниками) в ниже приведенную Табл. 2.
Таблица 2. Результаты работы с информационными источниками
| тема | «Растворы. Виды растворов» |
| , | |
| форма организации информации | Растворами называются гомогенные системы, содержащие не менее двух веществ. Могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Как правило, вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке — растворенным веществом. В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы. Газообразными растворами являются воздух и другие смеси газов. К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями. Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ, конечно же, является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол, четыреххлористый углерод и др. В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие — в ограниченных (хлорид натрия и вода). Сущность процесса образования раствора можно показать на примере растворения твердого вещества в жидкости. С точки зрения молекулярно-кинетической теории растворение протекает следующим образом: при внесении в растворитель какого-либо твердого вещества, например, поваренной соли, частицы ионов Na+ и Cl—, находящиеся на поверхности, в результате колебательного движения, увеличивающегося при соударении с частицами растворителя, могут отрываться и переходить в растворитель. Этот процесс распространяется на следующие слои частиц, которые обнажаются в кристалле после удаления поверхностного слоя. Так постепенно частицы, образующие кристалл (ионы или молекулы), переходят в раствор. Частицы, перешедшие в раствор, вследствие диффузии распределяются по всему объему растворителя. С другой стороны, по мере увеличения концентрации частицы (ионы, молекулы), находящиеся в непрерывном движении, при столкновении с твердой поверхностью еще не растворившегося вещества могут задерживаться на ней, т.е. растворение всегда сопровождается обратным явлением — кристаллизацией. Может наступить такой момент, когда одновременно выделяется из раствора столько же частиц (ионов, молекул), сколько их переходит в раствор — наступает равновесие. По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные. Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным. Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) — величина постоянная. Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным. Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы — растворы с небольшим содержанием растворенного вещества; концентрированные растворы — растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе. Сравнивая растворимость различных веществ, мы видим, что насыщенные растворы малорастворимых веществ являются разбавленными, а хорошо растворимых веществ — хотя и ненасыщенные, но довольно концентрированными. В зависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на молекулярные (растворы неэлектролитов) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток. |
2. Впишите в таблицу 3 характеристики растворов, расчеты по формулам и выводы.
Таблица 3. Результаты индивидуальных наблюдений и предварительные расчеты
| Характеристики растворов | |
| плотность исходного раствора (r исх) г/мл | 1,15г/мл |
| процентная концентрация исходного раствора (С исх), % | 14,35% (находим по справочнику соответственно плотности раствора) |
| процентная концентрация заданного раствора (С задан), % | |
| плотность заданного раствора (r задан) г/мл | 1,0921г/мл (находим по справочнику соответственно процентной концентрации заданного раствора) |
| Объем заданного раствора (V задан), мл | |
| Расчеты по формулам | |
| масса растворенного вещества (г) | |
| элементы | формула |
| C задан r задан m 100% V задан | 
|
| Вычисление | |
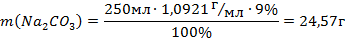
| |
| Объем исходного раствора (мл) | |
| элементы | формула |
| C исх m V исх r исх | 
|
| Вычисление | |

| |
| Выводы | |
| Последовательность действий для приготовления раствора заданной концентрации методом разбавления | Измерение плотности исходного раствора |
| Определение процентной концентрации исходного раствора по справочной таблице | |
| Определение плотности заданного раствора по справочной таблице | |
| Расчет массы растворенного вещества в заданном растворе | |
| Расчет объема исходного раствора | |
| Отбор рассчитанного объема исходного раствора мерным цилиндром | |
| Добавление воды до 250 мл | |
| Перемешивание | |
| Контрольное измерение плотности приготовленного раствора | |
| Для того, чтобы приготовить раствор заданной концентрации разбавлением раствора необходимо придерживаться алгоритма действий, указанного выше. |
3. Впишите в таблицу 4 значения плотности заданного и приготовленного раствора и выводы.
Таблица 4. Результаты измерений и предварительные соображения
| Характеристики заданного и приготовленного растворов | |
| Плотность заданного раствора (r задан) г/мл | 1,15г/мл |
| Плотность приготовленного раствора (r пр) г/мл | 1,0921г/мл |
| Выводы | |
| Последовательность действий для приготовления раствора заданной концентрации методом разбавления | Измерение плотности исходного раствора |
| Определение процентной концентрации исходного раствора по справочной таблице | |
| Определение плотности заданного раствора по справочной таблице | |
| Расчет массы растворенного вещества в заданном растворе | |
| Расчет объема исходного раствора | |
| Отбор рассчитанного объема исходного раствора мерным цилиндром | |
| Добавление воды до 250 мл | |
| Перемешивание | |
| Контрольное измерение плотности приготовленного раствора | |
| Придерживаясь алгоритма приготовления раствора заданной концентрации разбавлением раствора водой и производя предельно точные и правильные расчёты можно приготовить раствор указанной концетрации. |
4. Прикрепить свою работу в разделе «Загрузка файла» для проверки.