Методические указания для самостоятельной работы
«Общая химическая технология»
Нижнекамск
| Составитель: | ст. преп. Н.И. Мифтахова |
Методические указания для самостоятельной работы заочников и выполнения контрольных заданий по курсу «Общая химическая технология» / Нижнекамский химико-технологический институт: Сост.: Н.И. Мифтахова. - Нижнекамск.- 2014.- 27с.
Методические рекомендации предназначены для студентов специальностей 240401 «Химическая технология органических веществ» и направления бакалавриата 240100 «Химическая технология» по профилям «Химическая технология органических веществ» и «Химическая технология природных энергоносителей и углеродных материалов».
Подготовлены на кафедре химической технологии органических веществ Нижнекамского химико-технологического института.
 |
СОДЕРЖАНИЕ
| Введение…………………………………………………………....... | |
| Требования к выполнению и оформлению контрольных заданий. | |
| Стехиометрия химических превращений…………………………. | |
| Смещение химического равновесия……………………………….. | |
| Реакторы идеального вытеснения………………………………….. | |
| Реакторы идеального полного смешения………………………….. | |
| Варианты контрольных заданий………………………………........ | |
| Вариант 1…………………………………………………………... | |
| Вариант 2…………………………………………………………... | |
| Вариант 3…………………………………………………………... | |
| Вариант 4…………………………………………………………... | |
| Вариант 5…………………………………………………………... | |
| Вариант 6…………………………………………………………... | |
| Вариант 7…………………………………………………………... | |
| Вариант 8…………………………………………………………... | |
| Вариант 9…………………………………………………………... | |
| Вариант 10…………………………………………………………. | |
| Вариант 11…………………………………………………………. | |
| Вариант 12…………………………………………………………. | |
| Вариант 13…………………………………………………………. | |
| Вариант 14…………………………………………………………. | |
| Вариант 15…………………………………………………………. | |
| Вариант 16…………………………………………………………. | |
| Вариант 17…………………………………………………………. | |
| Вариант 18…………………………………………………………. | |
| Вариант 19…………………………………………………………. | |
| Вариант 20…………………………………………………………. | |
| Вариант 21…………………………………………………………. | |
| Список рекомендуемой литературы……………………………….. |
Введение
Курс «Общая химическая технология» рассматривает основные закономерности химических процессов, совокупность физических и химических явлений, из которых они складываются, и основные пути их реализации.
Овладение курсом позволит обеспечить в производственных условиях оптимальные технологические режимы, повышающие производительность труда, улучшить качество продукции, применять при проектировании рациональные типы оборудования, правильно оценивать результаты лабораторных исследований и быстро реализовывать их в производственных условиях.
Требования к выполнению и оформлению
контрольных заданий
Контрольная работа оформляется в тетради. Контрольная работа состоит из пяти заданий. Первое, четвертое и пятое задания являются практическими и отвечают следующим темам: «Равновесие химических реакций», «Стехиометрия химических превращений» и «Химические реакторы». Второе и третье задания требуют ответа на теоретические вопросы, в которых необходимо дать полный, развернутый ответ на поставленный вопрос. В конце работы необходимо указать список использованной литературы.
Вариант контрольной работы выбирается студентами по последним цифрам номера зачетной книжки с 1 по 21 вариант. Если последние цифры номера зачетной книжки больше 21, то вариант выбирается по сумме двух последних цифр. Например, последние цифры номера зачетной книжки 23, это соответствует 5 варианту контрольного задания.
Стехиометрия химических превращений.
Стехиометрические уравнения показывают, в каких соотношениях вещества вступают в химическое взаимодействие.
Общий вид стехиометрического уравнения:
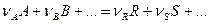
Уравнение устанавливает соотношение между количеством превратившихся веществ:

Степень превращения вещества – отношение количества превращенного вещества к его первоначальному количеству (1):
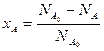
Степень превращения может быть определена для любого исходного реагента, например, 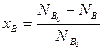
Из соотношения (1) и определений ХА и ХВ, получим связь между степенями превращения двух исходных веществ:
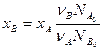
Можно определить количество любого вещества Ni в реагирующей смеси:
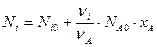
Если реакция протекает без изменения объема реакционной смеси или не происходит изменения общего количества реагирующих веществ, то степень превращения можно выразить через концентрации:
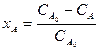
Для сложной реакции кроме степени превращения вводят дополнительные характеристики процесса: селективность процесса и выход продукта.
Селективность – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции.
Для двух параллельных реакций:
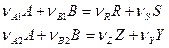
селективность по продукту R
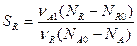
Для двух последовательных реакций:
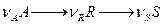
селективность по продукту R
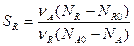
Выход продукта для продукта R
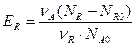
Уравнение, связывающее степень превращения исходного вещества, выход продукта и его интегральную селективность, имеет вид
Смещение химического равновесия.
Сместить химическое равновесие – это значит изменением внешних условий добиться преимущественного протекания прямой или обратной реакций. Общие закономерности этого явления были сформулированы Ле-Шателье в 1887 г.:
Если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие.
Чаще всего приходится сталкиваться со смещением равновесия в результате следующих изменений условий:
1)температура
Изменение температуры, в отличие от других внешних воздействий, влияет на значение константы равновесия. Повышение температуры вызывает ускорение той реакции, протекание которой сопровождается поглощением тепла (эндотермическая реакция). Напротив, понижение температуры благоприятствует протеканию экзотермической реакции – реакции, сопровождающейся выделением тепла.
2)давление
Повышение давления ускоряет ту реакцию, в которой происходит уменьшение количеств газообразных веществ, а понижение давления – реакцию, сопровождающуюся увеличением количеств газообразных веществ. Если количество газов в ходе реакции не изменяется, то изменение давления не оказывает влияния на положение химического равновесия.
3)концентрации
Добавление в реакционную систему какого-либо компонента смещает равновесие в сторону той реакции, где тот компонент расходуется. Отвод какого-либо вещества из реакционной системы, напротив, ускоряет реакцию, в которой это вещество образуется.
Реакторы идеального вытеснения.
РИВ-н – реакторы непрерывного действия, в которых осуществляется ламинарный гидродинамический режим.
В РИВ температура по длине реактора изменяется, что соответственно ведет к изменению константы скорости реакции. При расчете РИВ температуру, константу скорости считают постоянными.
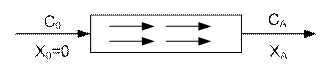
Внешний поток реагентов движется в одном заданном направлении, не перемешиваясь и вытесняя подобно поршню находящийся впереди частицы потока.

Время пребывания всех частиц в таком реакторе постоянно.
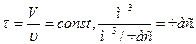
Все характеристики (концентрация, температура, степень превращения) изменяются плавно по объему реактора. Параметры процесса непостоянны во времени и по высоте трубы.
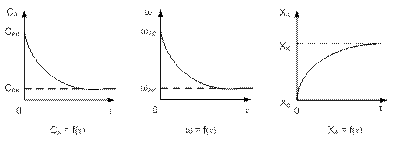
1)изменение концентрации реагентов;
2)изменение скорости реакции;
3)изменение степени превращения.
Данные уравнения позволяют определить время пребывания реагента для достижения заданной степени превращения, а затем и размеров реактора.
Для реакции нулевого порядка:
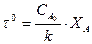
Для реакции первого порядка:
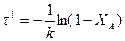
Для реакции второго порядка:
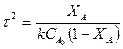
Реакторы идеального полного смешения (РИС-н).
РИС – реактор непрерывного действия, в котором осуществляется режим гидродинамического действия. В нем потоки реагентов смешиваются друг с другом и с продуктами химического превращения.
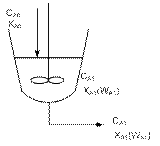
Во время его работы соблюдается стационарный режим, т.е. постоянство характеристик во времени. Нестационарный режим наблюдается во время пуска и остановки. В РИС-н перемешивающие устройства работают так интенсивно, что попадающие в реактор потоки реагента равномерно и мгновенно перемешиваются по объему всего реактора. В результате чего выравниваются параметры, которые характеризуют процесс.
Характеристические графики РИС-н во времени и объеме реактора.

СА0, СА – начальная и конечная концентрации реагентов в реакторе.
WA0, WA – начальная и конечная скорости процесса в реакторе.
Если известна кинетика процесса, то возможно рассчитать время, которое необходимо для достижения требуемой степени превращения.
Для необратимой реакции нулевого порядка 
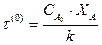
Для реакции первого порядка:
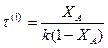
Зависит только от степени превращения и не зависит от концентрации СА0.
Для реакции второго порядка:
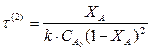
Варианты контрольных заданий
Вариант 1
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2СО(г) + О2(г) ↔ 2СO2(г)
С6Н6(г) ↔ С6Н12(г) + Н2(г)
2. Описать общую технологическую структуру химического производства, качественные и количественные критерии оценки эффективности химического производства.
3. Перечислить и сравнить способы получения термической фосфорной кислоты. Изобразить технологическую схему производства термической фосфорной кислоты двухступенчатым методом.
4. Протекают параллельные реакции:
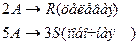
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=5 кмоль, NR=15 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 20%; 2) 95%. CA0=2,5 кмоль/м3, к=1,2.
Вариант 2
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
CuS(т) + O2(г) ↔ Cu(т) + SO2(г)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Описать общую технологическую схему химического производства, общие функции, основные технологические компоненты химического производства.
3. Описать свойства диоксида и триоксида серы, серной кислоты и олеума. Сорта серной кислоты, ее хранение и перевозка. Охарактеризовать виды серосодержащего сырья для производства серной кислоты.
4. Протекают последовательные реакции:
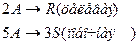
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=12 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 90%. CA0=3 кмоль/м3, к=1,8.
Вариант 3
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С4Н8(г) + Н2О(ж) ↔ (СН3)3СНО(ж)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Охарактеризовать сырьевые источники химического производства. Привести примеры использования отходов производства как источников вторичных материальных ресурсов. Перспективные и альтернативные источники сырь.
3. Описать химическую и структурную схемы производства серной кислоты контактным способом из колчедана.
4. Протекают параллельные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=7 кмоль, NS=1 кмоль.
5. 5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 80%. CA0=5 кмоль/м3, к=1.
Вариант 4
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С6Н6(г) + С2Н4(г) ↔ С6Н5С2Н5(ж)
С2Н4(г) ↔ С2Н2(г) + Н2(г)
2. Охарактеризовать сырьевые источники химического производства. Описать методы подготовки сырья в химико-технологическом процессе. Метод флотации.
3. Описать физико-химические основы обжига флотационного колчедана. Хранение и подготовка колчедана к обжигу. Описать устройство печей для обжига колчедана.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=9 кмоль, NS=1 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 23%; 2) 90%. CA0=6 кмоль/м3, к=2.
Вариант 5
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
СН2О(г) + Н2(г) ↔ СН3ОН(г)
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2. Описать классификацию химико-технологических процессов по условиям работы, по типу реакций, по состоянию реагирующих веществ.
3. Охарактеризовать печи для обжига колчедана, устройства для подачи колчедана в печи и удаление огарка. Использование огарка.
4. Протекают параллельные реакции:
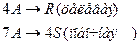
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=12 кмоль, NS=1 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 40%; 2) 95%. CA0=1,2 кмоль/м3, к=1,4.
Вариант 6
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
N2(г) + 3H2(г) ↔ 2NН3(г)
С6Н5–СН3(ж) + Н2(г) ↔ С6Н6(г) + СН4(г)
2. Описать технологическую схему промышленной водоподготовки. Вода как сырье и вспомогательный компонент производства. Источники воды.
3. Описать основы механической и электрической очистки обжигового газа в производстве серной кислоты от пыли, брызг и тумана.
4. Протекают последовательные реакции:
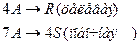
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=6 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 90%. CA0=4 кмоль/м3, к=1,6.
Вариант 7
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
4С2Н4(г) ↔ С5Н10(г) + С3Н6 (г)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Привести общую характеристику и классификацию энергетических ресурсов. Описать способы энерготехнологического комбинирования и использования энергетического потенциала сырья и тепла экзотермических реакций. Вторичные энергоресурсы.
3. Описать физико-химические основы каталитического окисления SO2 до SO3. Катализаторы процесса. Контактные аппараты.
4. Протекают параллельные реакции:
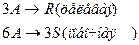
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=5 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 30%; 2) 75%. CA0=5 кмоль/м3, к=1,5.
Вариант 8
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С4Н10(г) ↔ С4Н6(г) + 2Н2(г)
С6Н6(г) ↔ С6Н12(г) + Н2(г)
2. Описать химическое производство как химико-технологическую систему, виды технологических связей элементов ХТС, их назначение и характеристика.
3. Описать физико-химические основы абсорбции серного ангидрида из газовой смеси в производстве серной кислоты. Аппаратурное оформление процесса.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=10 кмоль, NS=3 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 65%. CA0=4,5 кмоль/м3, к=2.
Вариант 9
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2С4Н8(г) ↔ С8Н16(ж)
С2Н4(г) ↔ С2Н2(г) + Н2(г)
2. Привести классификацию химико-технологических процессов, основные показатели ХТП, их взаимосвязь. Способы повышения эффективности ХТП.
3. Описать химическую и структурную схемы производства серной кислоты нитрозным способом.
4. Протекают параллельные реакции:
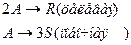
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=5 кмоль, NR=10 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 20%; 2) 90%. CA0=3,5 кмоль/м3, к=1.
Вариант 10
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
СН2О(г) + Н2(г) ↔ СН3ОН(г)
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2. Описать гомогенные химические процессы, влияние условий проведения и химических признаков на скорость превращения и дифференциальную селективность. Пути и способы интенсификации гомогенных процессов.
3. Описать современное состояние и перспективы развития азотной промышленности. Сырье для азотной промышленности. Методы фиксации азота.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=7 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 25%; 2) 85%. CA0=4 кмоль/м3, к=2,2.
Вариант 11
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2СО(г) + О2(г) ↔ 2СO2(г)
С2Н4(г) ↔ С2Н2(г) + Н2(г)
2. Представить и описать технологическую схему совмещенной каталитической конверсии метана и оксида углерода под атмосферным давлением.
3. Описать методы очистки технологических газов от СО2.
4. Протекают параллельные реакции:
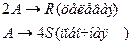
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=7 кмоль, NS=1 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 35%; 2) 75%. CA0=2,5 кмоль/м3, к=1,3.
Вариант 12
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
CuS(т) + O2(г) ↔ Cu(т) + SO2(г)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Изложить теоретические основы синтеза аммиака, обосновать оптимальные условия процесса и необходимость проведения синтеза аммиака по циклической схеме.
3. Описать методы очистки технологических газов от сернистых соединений.
4. Протекают последовательные реакции:
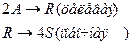
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=7 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 65%. CA0=1,5 кмоль/м3, к=1,4.
Вариант 13
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
N2(г) + 3H2(г) ↔ 2NН3(г)
С6Н6(г) ↔ С6Н12(г) + Н2(г)
2. Описать физико-химические основы и аппаратурное оформление процесса очистки обжигового газа от контактных ядов.
3. Представить и описать технологическую схему синтеза аммиака при среднем давлении.
4. Протекают параллельные реакции:
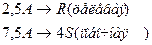
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=6 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 70%. CA0=1,6 кмоль/м3, к=1,8.
Вариант 14
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
4С2Н4(г) ↔ С5Н10(г) + С3Н6 (г)
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2. Описать технологическую схему и оборудование очистного отделения современного производства контактной серной кислоты из колчедана.
3. Изложить влияние различных факторов на процесс окисления аммиака в производстве азотной кислоты.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=7 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 40%; 2) 95%. CA0=2,4 кмоль/м3, к=2.
Вариант 15
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2СО(г) + О2(г) ↔ 2СO2(г)
С6Н5–СН3(ж) + Н2(г) ↔ С6Н6(г) + СН4(г)
2. Охарактеризовать катализаторы, применяемые в производстве серной кислоты контактным методом.
3. Изложить физико-химические основы процесса абсорбции диоксида азота водой в производстве разбавленной азотной кислоты.
4. Протекают параллельные реакции:
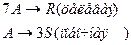
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=6 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 30%; 2) 75%. CA0=2,5 кмоль/м3, к=2,2.
Вариант 16
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С6Н6(г) ↔ С6Н12(г) + Н2(г)
4С2Н4(г) ↔ С5Н10(г) + С3Н6 (г)
2. Описать физико-химические основы нитрозного процесса получения серной кислоты.
3. Изложить теоретические основы разделения жидкого воздуха на азот и кислород методом ректификации.
4. Протекают последовательные реакции:
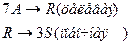
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=8 кмоль, NS=5 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 90%. CA0=3 кмоль/м3, к=1,8.
Вариант 17
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С2Н6(г) ↔ С2Н4(г) + Н2(г)
N2(г) + 3H2(г) ↔ 2NН3(г)
2. Описать оборудование башенных систем производства серной кислоты нитрозным методом.
3. Провести характеристику сырья для азотной промышленности.
4. Протекают параллельные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=9 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 65%. CA0=1,6 кмоль/м3, к=1,6.
Вариант 18
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С2Н6(г) ↔ С2Н4(г) + Н2(г)
CuS(т) + O2(г) ↔ Cu(т) + SO2(г)
2. Описать значение и область применения промышленного катализа. Сущность и виды катализа.
3. Описать технологию получения азотоводородной смеси методом паровоздушной конверсии метана.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=5 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 20%; 2) 90%. CA0=1,2 кмоль/м3, к=1,2.
Вариант 19
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С2Н4(г) ↔ С2Н2(г) + Н2(г)
СН2О(г) + Н2(г) ↔ СН3ОН(г)
2. Описать методы производства водорода конверсией углеводородных газов. Привести сравнительный анализ этих методов.
3. Описать методы очистки азотоводородной смеси от диоксида углерода и сероводорода.
4. Протекают параллельные реакции:
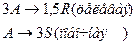
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=5 кмоль, NR=12 кмоль, NS=3 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 35%; 2) 75%. CA0=2 кмоль/м3, к=1,4.
Вариант 20
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2СО(г) + О2(г) ↔ 2СO2(г)
2. Описать производство водорода (азотоводородной смеси) разделением коксового газа.
3. Описать процесс переработки нитрозных газов в разбавленную азотную кислоту.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=12 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 65%. CA0=4,5 кмоль/м3, к=1,5.
Вариант 21
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2С4Н8(г) ↔ С8Н16(ж)
2СО(г) + О2(г) ↔ 2СO2(г)
2. Изложить особенности сернокисло