Оксиды и их свойства.
Сегодня мы начинаем знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые и сложные.

| ОКСИД | КИСЛОТА | ОСНОВАНИЕ | СОЛЬ |
| ЭхОу | НnA А – кислотный остаток | Ме(ОН)b ОН – гидроксильная группа | MenAb |
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Называются они просто - "оксид + название элемента" (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
| Формула | Название | Формула | Название |
| CO | оксид углерода (II) | Fe2O3 | оксид железа (III) |
| NO | оксид азота (II) | CrO3 | оксид хрома (VI) |
| Al2O3 | оксид алюминия | ZnO | оксид цинка |
| N2O5 | оксид азота (V) | Mn2O7 | оксид марганца (VII) |
Классификация оксидов
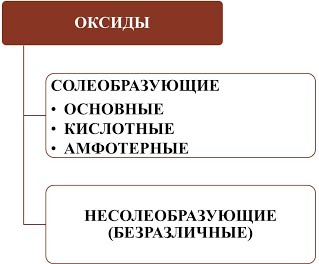
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
| Оксиды металлов МехОу | Оксиды неметаллов неМехОу | |||
| Основные | Кислотные | Амфотерные | Кислотные | Безразличные |
| I, II Ме | V-VII Me | ZnO,BeO,Al2O3, Fe2O3, Cr2O3 | > II неМе | I, II неМе CO, NO, N2O |
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксидыметаллов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):

2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 - оксид марганца (VII)):

3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например,N2O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO (II - основный);
Cr 2O3 (III - амфотерный);
CrO3 (VII - кислотный).
Классификация оксидов
(по растворимости в воде)
| Кислотные оксиды | Основные оксиды | Амфотерные оксиды |
| Растворимы в воде. Исключение –SiO2 (не растворим в воде) | В воде растворяются только оксиды щелочных и щелочноземельных металлов (это металлы I «А» и II «А» групп, исключение Be,Mg) | С водой не взаимодействуют. В воде не растворимы |
Выполните задания:
Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
NaOH, AlCl3, K2O, H2SO4, SO3, P2O5, HNO3, CaO, CO.
2. Даны вещества: CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3, Zn(OH)2, N2O5, Al2O3, Ca(OH)2, N2O, FeO, SO3, Na2SO4, ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3.
Выпишете оксиды и классифицируйте их.
Получение оксидов
Тренажёр "Взаимодействие кислорода с простыми веществами"
| 1. Горение веществ (Окисление кислородом) | а) простых веществ Тренажёр "Взаимодействие кислорода с простыми веществами" | 2Mg +O2=2MgO |
| б) сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
| 2.Разложение сложных веществ (используйте таблицу кислот, см. приложения) | а) солей СОЛЬt= ОСНОВНЫЙ ОКСИД+КИСЛОТНЫЙ ОКСИД | СaCO3=CaO+CO2 |
| б) Нерастворимых оснований Ме(ОН)b t= MexOy + H2O | Cu (OH)2 t=CuO+H2O | |
| в) кислородсодержащих кислот НnA = КИСЛОТНЫЙ ОКСИД + H2O | H2SO3=H2O+SO2 |