Семинар по теориям химической кинетики
В настоящее время основными теориями кимической кинетики являются%
-Теория активных соударений (ТАС)
- Теория активированного комплекса (теория абсолютных скоростей) (ТАК)
Основные факторы протекания реакции в теории ТАС
1. Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция (Z0ДВ).
2. Молекула в ходе соударения с другой молекулой должна быть значительно деформирована, чтобы соответствующие атомы могли образуя новые связи, дать продукты. Для такой деформации необходима затрата значительной энергии – энергии активации (Ea), которую ТАС можно определить как минимально необходимую энергию, которой должна обладать молекула в момент столкновения (Z*ДВ), чтобы прореагировать. Иными словами в реакции участвуют активные частицы, доля которых составляет примерно от 10-20 до 10-10. Если меньше, то реакция не происходит.
3. Молекулы должны быть правильно ориентированы относительно друг друга. В связи с этим в уравнение скорости вводится стерический множитель (P), учитывающий отклонение теоретических расчетов от опытных данных.
Окончательно
W ~ pZ*дв ~ pZ0дв*e-Ea/RT
После вывода конечного выражения для скорости бимолекулярной реакции: А + ВàПр
Получим следующее выражение:
WА = kтеорСAСВ = p sАsB UАB NA 10 3 * СAСВ , где
sА , sB - газокинетические диаметры молекул,
 - среднеарифметическая скорость частиц
- среднеарифметическая скорость частиц
Теория активных столкновений
У р а в н е н и е А р р е н и у с а. Скорость химических реакций обычно сильно зависит от температуры. Так, по правилу Вант - Гоффа для реакций в растворах при повышении температуры на десять градусов скорость увеличивается в 2-3 раза. Математически зависимость константы скорости от температуры выражается экспоненциальным уравнением Аррениуса k = А × exp (-  ),
),
параметры которого называются: А - предэкспонентом, Еa - энергией активации.
В логарифмической форме уравнение Аррениуса принимает линейную форму от обратной температуры
ln k = ln А −  = a + b*x (1)
= a + b*x (1)
a= ln А и b = – E/R
Параметры уравнения Аррениуса определяются экспериментально при изучении температурной зависимости константы скорости.
При большем количестве опытных точек, строят график зависимости ln k = f(1/T), угловой коэффициент наклона которого равен -Е/R в соответствии с уравнением (2.2). Так как температурный интервал экспериментальных данных обычно не превышает нескольких десятков градусов, графическое определение предэкспонента А затруднено из-за необходимости далекой экстраполяции. Поэтому величину А рассчитывают аналитически из уравнения 2.1, используя экспериментальные значения k при разных температурах и найденное значение энергии активации.
П р и м е р 1
Для реакции йодистого этила с алкоголятом натрия в этиловом спирте
CH3I + C2H5O- = CH3OC2H5 + I-
найдены следующие значения константы скорости второго порядка
| t, 0C | |||||
| k×105, л/(мол××с) | 5,00 | 11,8 | 24,5 | 48,8 |
Определить энергию активации реакции и предэкспоненциальный член уравнения Аррениуса, рассчитать константу скорости при 15 о С.
Решение. Рассчитаем необходимые для построения графика величины
| T, K | |||||
| T-1×103, К- 1 | 3,663 | 3,584 | 3,508 | 3,436 | 3,367 |
| ln k | -9,9035 | -9,0448 | -8,3143 | -7,625 | -6,908 |
(Обращаем Ваше внимание на то, что при расчете величин 1/T нужна учитывать третий знак после запятой, так как область изменения аргумента составляет всего 0,3 единицы и в противном случае точность определения искомой величины не будет соответствовать точности экспериментальных данных)
Построим график ln k - 1/T и найдем угловой коэффициент его наклона (рис. 2.1)
|

Рис. 2.1. Зависимость логарифма константы скорости реакции от обратной температуры.
- Обработка графической зависимости.
Из уравнения прямой у = a + b*x = 26,8326 – 10020,76*х
Отсюда E = - R × b = 8,314 Дж/(моль×К) × 10020,76 = 83306 Дж/моль = 83,3 кДж/моль.
ln А = a = 26,83 отсюда А = 4, 50 ×1011 л/(моль×с)
(размерность А совпадает с размерностью константы скорости соответствующего порядка).
- Если имеются значения константы скорости при двух температурах, то энергия активации рассчитывается по формуле

Еa = 8,314*273*285*ln(24,5*10-5/5*10-5)/(285-273) = 83200 Дж/моль
- (А) можно получить из значения Е и любой точки по k.
Для расчета предэкспонента используем значение k при 24оС (точка хорошо лежит на графике)
ln А = ln k + Ea/RT = - 6,908 + 83200/297*8,314 = - 6,905+33737 = 26,8.
Можно использовать также значение свободного члена в регрессионном уравнении. Отсюда А = 4, 45 ×1011 л/(моль×с)
- Используя найденные параметры уравнения Аррениуса можно определить константу скорости данной реакции при любой температуре в рабочем интервале, например при 15оС
k15 =4,50×1011× exp [-83300/(8,314×288)]= 4,50 ×1011 ×7,786 ×10-16 =
=35,0.10-5 л/(моль.с)
П р и м е р 2
Рассчитать теоретическое значение предэкспонента уравнения Аррениуса и константы скорости при 500 К для реакции
Н + С2Н6 = Н2 + С2Н5,
еслипринять, что средний газокинетический диаметр молекул реагентов равен s=3,5 Å, а энергия активации составляет 116,8 кДж/моль. Сравнить теоретическое значение предэкспонента с его экспериментальной величиной А = 2,3×109 л/(моль×с) и вычислить значение стерического множителя.
Решение
- Константа скорости бимолекулярной реакции в теории ТАС равна:
kТЕОР = p sАB 2uАB NA 10 3exp ( ) = АТЕОР* exp (
) = АТЕОР* exp ( )
)
где АТЕОР = p sАB 2uАB NA 10 3
- Среднеарифметическая скорость частиц равна:
uАB =  =
= 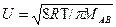 ,
,
- Приведенная молярная масса реагентов MАВ
1/ MАВ = 1/MA +1/MB или MАВ = MA MB/(MA +MB) в кг/моль
MАВ = 1×30/(1+ 30) = 0,968 г/моль = 0,968×10- 3 кг/моль