u =  = 3307 м/с.
= 3307 м/с.
1 Дж = кг·м²/с²
[Ö(кг·м² Кмоль/с² моль Ккг ] = м/с.
- Вычисляем значение предэкспонента АТЕОР
для NA = 6,02×1023 кмоль-1 и s=3,5 Å = 3,5*10-8 см = 3,5*10-10 м
АТЕОР = p sАB 2uАB NA 10 3 = 3,14×(3,5×10-10)2 м2 × 3307 м/с × 6,02×1023 моль-1 10 3 =
= 7,66×1011 м3/(кмоль×с) = 7,66×1011 л/(моль×с).
- Константы скорости по уравнению kТЕОР = АТЕОР* exp (
 )
)
kтеор =7,66×1011л/(моль×с)×exp(-96000Дж/моль/[8,314Дж/(моль×К)×500 К] =
= 0,583 л/(моль×с).
- Рассчитаем значение стерического множителя по формуле
р = Аэксп / AТЕОР = 2,29×109/7,66×1011 = 3,0×10-3 << 1
Величина стерического множителя позволяет отнести реакцию к типу реакции “медленных”.
Классификация.
- “медленные” р << 1
- “быстрые” р >> 1
- “нормальные” р » 1
Теория активированного комплекса для бимолекулярной реакции.
По теории активированного комплекса для протекания элементарного акта химической реакции реагирующая система должна достичь критической конфигурации атомов, называемой активированным комплексом (или переходное состояние - ПС), который соответствует вершине потенциального барьера на оптимальном пути реакции, характеризующемся минимальной высотой этого барьера на поверхности потенциальной энергии (ППЭ) реакции. Отсюда скорость реакции будет определяться концентрацией активированного комплекса (С¹) и частотой его превращения в продукт. Это справедливо для адиабатических реакций, элементарные акты которых протекают в пределах одного электронного терма реагирующей системы (одной ППЭ),
• Для реакции: А + В àПр
W = c *n¹ C¹, где
n¹ = kбT/h [c-1] - частота распада АК, эффективная скорость перехода АК через энергетический барьер;
c ³ 1 - трансэмиссионный коэффициент, показывает долю АК, переходящих в продукты.
Путь химической реакции
Неоднократные попытки разработать общий алгоритм для локализации переходного состояния привели к концепции пути химической реакции.
Согласно классическому определению Эйринга и Поляни (1931 г.), путь химической реакции - это путь минимальной энергии реакции, соединяющий соседние минимумы ППЭ через седловую точку переходного состояния ПС.
Основные положения ТАК
• АК следует рассматривать как обычную молекулу с обычными термодинамическими свойствами при одном допущении: движение вдоль координаты реакции приводит к его распаду с определенной скоростью. (qпост переходит в qкол)
• Элементарный акт реакции происходит адиабатически, т.е. ядра движутся независимо от движения электронов. Потенциальная энергия U при движении ядер изменяется непрерывно и является функцией межъядерных расстояний
• Исходные вещества и активированный комплекс находится в состоянии равновесия
• Протекание реакции распада активированного комплекса не смещает равновесие в первой стадии
Механизм реакции можно представить как совокупность двух стадий:
k1
А + В «АВ¹
k-1
k2
АВ¹ ® Пр
Концентрация активированного комплекса найдем в предположении, что активированный комплекс находится в равновесии с реагентами по методу квазиравновесных концентраций (МКРК).
Отсюда скорость реакции можно записать так:
W = 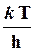 × К¹×CACB,
× К¹×CACB,
Используя термодинамический подход к описанию равновесия, можно выразить константу равновесия через термодинамические функции
−RT ln К¹ = DGo¹ = DH o¹ − TDSo ¹, (2.20)
где DGo¹, DHo¹ и DSo¹ - стандартные значения соответственно знергии Гиббса, энтальпии и энтропии процесса образования активированного комплекса из реагентов.
При использовании уравнений (2.19) − (2.21) получим выражение для константы скорости:
kс[л/моль*время] =  × Кс¹ =
× Кс¹ = 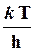 × exp (−
× exp (−  ) × exp (
) × exp ( )* (Сº)1-n.
)* (Сº)1-n.
kр[1/(атмn-1·время)] = kр =  × Кр¹
× Кр¹ 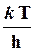 × exp (−
× exp (−  ) × exp (
) × exp ( ) (Рº)1-n.
) (Рº)1-n.
Если реакция протекает в газовой фазе, то P=CRT C= RT/P тогда п ри изменении стандарта константу скорости в единицах концентрации следует пересчитать по формуле
kр[1/(атмn-1·время)] = kс [(л/моль)n-1/время]*(RT)1-n, (2.21)
где R = 0,082 л·атм/(моль·К)
Расчет энтальпии активации.
- Для реакции в газовой фазе
Величина DHo¹ примерно соответствует энергии активации Аррениуса, более точно
DHo¹ = Е − nRT, (2.23)
где - n равно числу молекул, образующих активированный комплекс в газовой фазе.
- Для реакции в растворе n = 1 и DHo¹ = Е − RT
- Величину DHo¹ можно рассчитать непосредственно из экспериментальных данных:
ln(k1*T2/k2*T1) = - DHo¹/R*(1/T1 -1/T2)