Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 1.
Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2 равна 4·10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и скорость, когда разложится 25% N2O.
Определить, в какую сторону сместится равновесие при:

Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 2
Равновесие гомогенной системы 4НСl(г) + О2(г) ↔ 2Н2О(г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ: [Н2О]р = 0,21 моль/л; [Cl2]р = 0,14 моль/л; [HCI]p = 0,30 моль/л; [О2]р = 0,48 моль/л. Вычислите исходные концентрации хлороводорода и кислорода.
Определить, в какую сторону сместится равновесие при:

Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 3
Вычислите константу равновесия для гомогенной системы CO(г) + H2O(г) ↔ CO2(г) + H2(г) если равновесные концентрации реагирующих веществ: [СО]р = 0,008 моль/л; [Н2О]р = 0,064 моль/л; [CО2]р = 0,032 моль/л; [Н2]р = 0,032 моль/л. Чему равны исходные концентрации воды и СО?
Определить, в какую сторону сместится равновесие при:
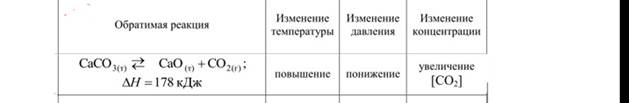
Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 4
Константа равновесия гомогенной системы CO(г) + H2O(г) ↔ CO2(г) + H2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]исх = 0,20 моль/л; [Н2О]исх = 0,80 моль/л.
Определить, в какую сторону сместится равновесие при:

Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 5.
Константа равновесия гомогенной системы N2 + 3H2 ↔ 2NH3 при некоторой температуре равна 0,2. Равновесные концентрации водорода и аммиака соответственно равны 0,1 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
Определить, в какую сторону сместится равновесие при:
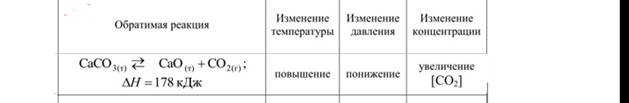
Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 6
При некоторой температуре равновесие гомогенной системы 2NО+ О2 ↔ 2NО2 установилось при следующих концентрациях реагирующих веществ: [NO]р = 0,4 моль/л; [О2]р = 0,2 моль/л; [NО2]р = 0,4 моль/л. Вычислите константу равновесия и исходную концентрацию NО и О2.
Определить, в какую сторону сместится равновесие при:

Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 7
Исходные концентрации [NO]исх и [С12]исх в гомогенной системе 2NO + Cl2 = 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 40% N0.
Определить, в какую сторону сместится равновесие при:
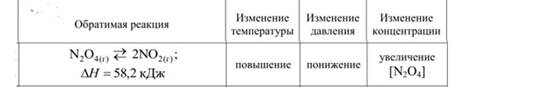
Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 8
Окисление серы и ее оксида (IV) протекает по уравнениям: а) S(к)+ О2 (г) = SО2(г); б) 2SО2(г)+ О2 (г) = 2SО3(г). Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Определить, в какую сторону сместится равновесие при:

Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 9.
Реакция идет по уравнению N2 + О2 ↔ 2NО. Концентрации исходных веществ до начала реакции были: [N2] = 0,098 моль/л; [О2] = 0,02 моль/л. Вычислите концентрацию этих веществ в момент, когда [NО] = 0,01 моль/л.
Определить, в какую сторону сместится равновесие при:
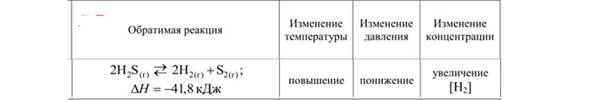
Самостоятельная работа по теме: «Кинетика и равновесие гомогенных химических реакций»
Вариант 10.
Реакция идет по уравнению N2 + 3H2 ↔ 2NH3. Концентрации участвующих в ней веществ были: [N2 ] = 1,6 моль/л.; [Н2 ] = 4,5 моль/л.; [NН3 ] = 0,40 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 1 моль/л.
Определить, в какую сторону сместится равновесие при:
