Система доставки удалена. Выполнена контрольная аортография: коронарные артерии проходимы (рис.3).
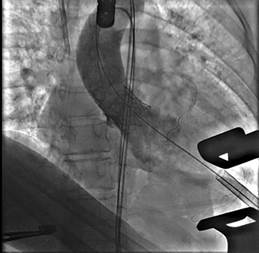
Рис.3. Контрольная ангиография корня аорты
Чрезпищеводная ЭхоКГ – створки клапана раскрыты полностью, минимальная фистула в 1 мм в области аорто-митрального сочленения. На финальной коронароангиографии видна субокклюзия устья ствола левой коронарной артерии (отдавлен извне кальцинированным конгломератом при имплантации аортального клапана трансапикальным доступом), кровоток TIMI 1. Учитывая высокий риск летального исхода выполнена баллонная ангиопластика и стентирование ствола левой коронарной артерии. Стент расправлен полностью, диссекций нет. Инструменты удалены, наложена давящая асептическая повязка (рис.4).
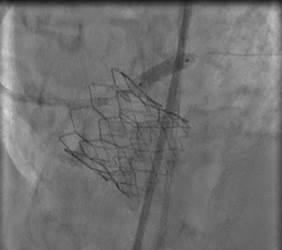
Рис. 4. Стентирование ствола левой коронарной артерии
Послеоперационная ЭхоКГ с допплеровским анализом кровотока: левый желудочек увеличен. Миокард левого желудочка выражено и симметрично утолщен. Асинхронное сокращение стенок левого желудочка. Диастолическая дисфункция левого желудочка. Левое предсердие увеличено. Правое предсердие увеличено. Аорта незначительно расширена в восходящем отделе, стенки уплотнены, утолщены. В проекции аортального клапана лоцируется биологический протез на каркасе. Поток несколько ускорен. Значимой транспротезной и парапротезной регургитации не выявлено. Давление в ЛА повышено (60 мм рт ст.). ЛГ 2 ст. Обзорная рентгенография легких (24.09.2020). Легкие расправлены, дренажи в левой плевральной полости. Тень сердца расширена, состояние после TAVI. Контур диафрагмы слева нечеткий. Жидкость в плевральных полостях слева. Заключение – левосторонний гидроторакс. Лабораторные исследования. (24.09.2020 18:24) Тропонин Т высокочувствительный 186 нг/л (<14); (24.09.2020 20:47) Тропонин Т высокочувствительный 698 нг/л (<14).
В послеоперационном периоде пациентка находилась в отделении реанимации и интенсивной терапии. Отмечалась нестабильность гемодинамики, в связи с чем получала вазопрессорную и инотропную поддержку. На 2е сутки состояние стабилизировалось. На 5е сутки переведена в профильное отделение, получала лечение согласно стандартам оказания медицинской помощи. На 20е сутки после оперативного вмешательства выписана из стационара.
При выписке даны рекомендации:
1. Диспансерное наблюдение у кардиолога 1 раз в год.
2. Эхо-КГ в течение 30 дней после выписки, далее 1 раз/год.
3. Двойная антиагрегантная терапия (Клопидогрел 75 мг/сутки + Ацетилсалициловая кислота 100 мг/сутки) в первые 3 месяца, с дальнейшим переходом на монотерапию.
Обсуждение
Изначально, транскатетерная имплантация аортального клапана рассматривалась, как операция спасения для пациентов с тяжелым аортальным стенозом, имеющих высокий хирургический риск. Однако, на сегодняшний день появляется все больше данных о преимуществе TAVI над операцией на открытом сердце у пациентов промежуточного и низкого риска, ввиду малоинвазивности данной процедуры, меньшего риска развитии интра- и послеоперационных осложнений и благоприятных отдаленных последствий в виде увеличения процента выживаемости и повышения функционального статуса прооперированных пациентов. Однако, несмотря все плюсы, при данной операции сохраняется высокий риск развития цереброваскулярных осложнений, а так же высокие показатели регургитации и частоты установки электрокардиостимулятора. [3]
Как любое хирургическое вмешательство, ТИАК имеет ряд специфических осложнений, которые можно классифицировать на:
· интра и послеоперационные
· связанные с доступом и, непосредственно, с наличием биопротеза (Таб. 1)[4]
Таблица 1
| Связанные с доступом | Связанные с наличием биопротеза |
| Диссекция сосуда | Инсульт |
| Стеноз сосуда | Атриовентрикулярная блокада |
| Кровотечение в месте доступа | Тромбоз биопротеза |
| Инфицирование места доступа | Структурные дисфункции |
| Тромбоз сосуда | Неструктурные дисфункции |
| Аневризмы | Мальпозиционирование протеза |
| Псевдоаневризмы | Кровотечение |
| Разрыв сосуда | Инфекционный эндокардит клапанного протеза |
| Разрыв миокарда | |
| Образование рубцов |
В представленном клиническом случае развилось такое интраоперационное осложнение, как обструкция левой коронарной артерии створкой нативного клапана, которое можно отнести к группе структурным дисфункций.
По данным различных исследований данное осложнение развивается в 0,66% случаев всех ТИАК, причем в 88,6% случаев связано с левой коронарной артерией. [2, 8] В 98% случаев обструкция коронарной артерии была связана со смещением нативной кальцинированной бляшки [8, 10].
В сложившейся ситуации необходимо своевременное принятие мер по восстановлению кровотока в пораженной артерии.
Учитывая всю тяжесть этого осложнения необходимо уметь не только его диагностировать, но и предотвратить.
В большинстве случаев окклюзия коронарных артерий сопровождается стойкой гипотензией, изменением сегмента ST и желудочковыми аритмиями, которые без лечения приводят непосредственно к смерти пациента. В одном из исследований так же говорится о том, что изменение сегмента ST в виде подъема, диагностируется только в 56% случаев. Поэтому важно иметь выполнять ЭХО-КГ или КАГ, когда это необходимо[2, 9].
На основе анализа представленной литературы можно выделить следующие факторы риска коронарной обструкции во время ТИАК [2, 9]:
1. Низкое положение устья коронарной артерии (расстояние от корня аорты до устья коронарной артерии). Так в систематическом обзоре 24 случаев коронарной обструкции при ТИАК средняя высота устьев составила 10,3 мм (от 7 до 12 мм).
2. Узкий корень аорты с неглубокими синусами Вальсальвы, что создает мало места для нативных створок клапана после раскрытия протеза. По данным того же систематического обзора средний диаметр составил 28 мм (от 26 мм до 33 мм).
3. Женский пол, что объясняется меньшим диаметром корня аорты, который в комбинации с низким положением устья коронарной артерии может привести к данному осложнению.
4. Использование баллоннорасширяемого клапана.
5. Тяжесть кальцинации клапана, наличие объемных кальцинированных образований на нативных левой или правой створках по видимому так же играет огромную роль, однако ни в одном исследовании не учитывалось.
6. Диаметр синусов Вальсальвы менее 30 мм
Таким образом, для прогнозирования данного осложнения необходимо учитывать следующие анатомические и технические данные:
1. Диаметр синотубулярного соустья
2. Высота и глубина синусов Вальсальвы
3. Высота устья коронарной артерии
4. Оценка кальциноза створок клапана
5. Высота уплотнительной балки протеза
6. Глубина имплантации протеза
7. Ориентация коммисуры
Все это говорит о необходимости тщательного обследования перед операцией, а именно возможность выполнения КТ ангиографии, а так же проведение коронароангиографии непосредственно во время ТИАК.
В статьях, освещающих данную проблему, рекомендуются такие меры защиты коронарной артерии, как проведение проводника в заинтересованную артерию перед установкой клапана, стентирование коронарной артерии до или во время TAVI, а так же использование протеза клапана, который может быть смещен /извлечен при развитии коронарной обструкции с последующей повторной имплантацией клапана.[2, 10] Однако превентивное стентирование несет ряд ограничений:
· необходимости приема двойной антитромботической терапии, что может непосредственно сказаться на ходе операции;
· увеличение объема вводимого контраста;
· увеличение риска сосудистых и геморрагических осложнений.[2].
В ранее упомянутом источнике так же говорится о том, что в перспективе развития данного осложнения лучше использование баллоннорасширяемых клапанов. Это объясняется более легким доступом к коронарной артерии из-за более низкой высотой стояния клапана по отношению к устью коронарной артерии, а так же широкими ячейками клапана, что облегчает прохождения проводника и инструментов для стентирования через них. [10]
Даже при успешном восстановлении кровотока по коронарной артерии путем стентирования, пациент находится в группе риска по развитию тромбоэмболических осложнений в будущем.
Наличие биологического протеза по данным многих исследований само по себе сопряжено с большим риском его тромбоза, с последующим отрывом тромбов и их миграцией по сосудам большого круга кровообращения, что в первую очередь опасно эмболией сосудов головного мозга с развитием цереброваскулярных осложнений. Так же в литературе описаны случаи эмболии ранее интактных коронарных артерий.
При имплантация биопротеза происходит травмирование эндотелия в зоне установки клапана, а так же создаются зоны турбулентного тока крови вокруг биопротеза, что согласно триаде Вирхова является факторами тромбообразования. Помимо этого, после установки клапана создаются так называемые «слепые карманы» в зоне аортальных синусов, образованные стенкой биопротеза, непосредственно аортой и нативными створками. Тромботические массы, которые в них образуются и накапливаются, часто служат источником эмболий (рис.5).
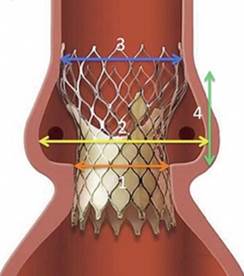
Рис. 5. «Слепые карманы» после имплантации клапана
Наличие дополнительных металлических конструкций в виде стента в непосредственной близости с потенциальным источником тромбов увеличивает риски тромбоэмболических осложнений в несколько раз.
Поэтому необходимо наблюдение за данными пациентами в ближайшем и отдаленном послеоперационном периоде для предупреждения и своевременного диагностирования предикторов данного осложнения, что на данный момент остается сложной задачей. Это обусловлено, как правило, отсутствием явной клинической симптоматики и необходимостью проведения дорогостоящих методов диагностики, таких как КТ ангиография. ЭХО-КГ, не смотря на свою информативность непосредственно при планировании операции, после установления биопротеза теряет свою эффективность из-за помех, создаваемых механическим каркасом клапана.
Сложность так же заключается в отсутствии четких критериев лабораторного контроля показателей гемостаза (тромбоэластометрия, индуцированная агрегация тромбоцитов), а так же единой стратегии профилактики тромбоэмболических осложнений. Так, в рекомендациях Американской ассоциации кардиологов 2017 года указаны две схемы:
1. Назначение двойной антиагрегантной терапии (АСК и Клопидогрел в поддерживающих дозах) в течение 6 месяцев, в последующим пожизненным приемом АСК либо
2. Назначение антагонистов витамина К (Варфарин) в течение 3 месяцев при целевом МНО 2,5 с последующим переходом на пожизненный прием АСК.[7] (9)
В рекомендациях Европейского сообщества кардиологов рекомендуется двойная антиагрегантная терапия в течение 3-6 месяцев, с дальнейшем переходом на один антиагрегантный препарат. У пациентов высокого риска кровотечения может быть рассмотрена монотерапия.[1]
Литература
1. Baumgartner H. [и др.]. 2017 ESC/EACTS Guidelines for the management of valvular heart disease // European Heart Journal. 2017. № 36 (38). C. 2739–2786.
2. Combaret N. [и др.]. TAVI and coronary revascularization // Annales de Cardiologie et d’Angeiologie. 2019. Т. 68. № 6. C. 423–428.
3. Eggebrecht H. [и др.]. Incidence and outcomes of emergent cardiac surgery during transfemoral transcatheter aortic valve implantation (TAVI): Insights from the e uropean R egistry on e mergent C ardiac S urgery during TAVI (EuRECS-TAVI) // European Heart Journal. 2018. № 8 (39). C. 676–684.
4. Howard C. [и др.]. TAVI and the future of aortic valve replacement // Journal of Cardiac Surgery. 2019. Т. 34. № 12. C. 1577–1590.
5. Krasopoulos G. [и др.]. European real world trans-catheter aortic valve implantation: Systematic review and meta-analysis of European national registries // Journal of Cardiothoracic Surgery. 2016. № 1 (11).
6. Mack M. [и др.]. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients // New England Journal of Medicine. 2019. № 18 (380). C. 1695–1705.
7. Nishimura R. A. [и др.]. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients with Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines // Circulation. 2017. № 25 (135). C. e1159–e1195.
8. Pfeiffer S. [и др.]. Coronary obstruction following TAVI valve-in-valve: Could we prevent it? // Catheterization and Cardiovascular Interventions. 2013. Т. 81. № 2. C. 386.
9. Ribeiro H. B. [и др.]. Coronary obstruction following transcatheter aortic valve implantation: A systematic review // JACC: Cardiovascular Interventions. 2013. № 5 (6). C. 452–461.
10. Ribeiro H. B. [и др.]. Predictive factors, management, and clinical outcomes of coronary obstruction following transcatheter aortic valve implantation: Insights from a large multicenter registry // Journal of the American College of Cardiology. 2013. № 17 (62). C. 1552–1562.
11. Vahl T. P., Kodali S. K., Leon M. B. Transcatheter Aortic Valve Replacement 2016: A Modern-Day «through the Looking-Glass» Adventure // Journal of the American College of Cardiology. 2016. № 12 (67). C. 1472–1487.