Выше было показано, что способность атомов углерода к образованию четырех ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава — изомеров.
Все изомеры делят на два больших класса — структурные изомеры и стереоизомеры (пространственные изомеры). Структурными называют изомеры, отвечающие различным структурным формулам органических соединений. Стереоизомеры имеют одинаковые заместители у каждого атома углерода и отличаются лишь их взаимным расположением в пространстве.
СТРУКТУРНЫЕ ИЗОМЕРЫ
В соответствии с приведенной выше классификацией органических соединений по типам среди структурных изомеров выделяют три группы:
■ соединения, отличающиеся углеродными скелетами:
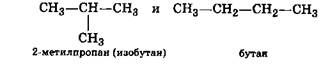
■ соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например:
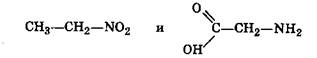
нитроэтан аминоуксусная кислота (глицин)
■ соединения, отличающиеся положением заместителя или кратной связи в молекуле:
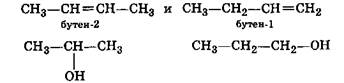
|
пропанол-2 (изопропиловый спирт) пропанол-1 (пропиловый спирт)
Примеры
орто-, пара и мета- изомерии:
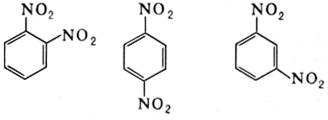
1,2-динитробензол 1,3-динитробензол 1,4-динитробензол
(о -динитробензол) (п-динитробензол) (м-динитробензол)
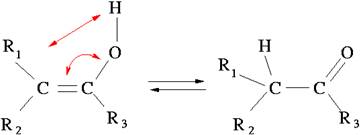
Таутомерия – это подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами). Например, кето-енольная таутомерия (слева – енольная фома, справа –кето-форма):
СТЕРЕОИЗОМЕРЫ
Стереоизомеры можно также разделить на два типа: геометрические изомеры и оптические изомеры.
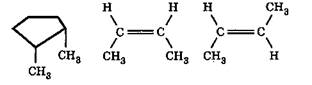
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-положение) или по разные стороны (транс-положение) этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счет разрыва одной из химических связей, то говорят о наличии геометрических изомеров. Геометрические изомеры отличаются своими физическими и химическими свойствами:
|
|
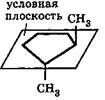
транс- 1,2- диметил циклопентан
|
цис -1,2-диметил циклопентан цис -бутен-2 транс -бутен-2
Оптическими изомерами называют молекулы, зеркальные изображения которых несовместимы друг с другом (то есть не совпадают при любых поворотах и переворотах на плоскости, при которых не разрываются химические связи). Таким свойством обладают молекулы, имеющие асимметрический центр — атом углерода, связанный с четырьмя различными заместителями. Например, в виде двух оптических изомеров существует молекула бутанола-2, содержащая один асимметрический центр (показан изогнутыми стрелками):
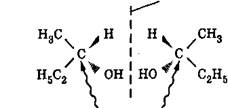
зеркальная плоскость
Ассиметрический центр (хиральный атом С)
В отличие от геометрических изомеров, оптические изомеры обладают одинаковыми физическими (температуры плавления, кипения т. п.) и химическими свойствами. Различие между оптическими изомерами проявляется только по отношению к асимметрическим воздействиям. Одним из примеров такого воздействия является пропускание плоскополяризованного света через раствор органического соединения. Оптические изомеры вращают плоскость поляризации такого света в различные стороны на один и тот же угол. Изомер, вращающий плоскость поляризации вправо, обозначается буквой D, а влево — буквой L.
|
|
(Существует и другой способ обозначения изомеров, содержащих хиральный атом С – так называемая система Кана-Ингольда-Прелога или R,S-номенклатура, принципы которой мы рассматривать не будем).
Смесь двух оптических изомеров в равных отношениях (т. наз. рацемическая смесь или рацемат) не способна изменить плоскость поляризации света. Таким образом, способность вещества изменить плоскость поляризации света (т.е. оптическая активность) указывает на наличие оптических изомеров в неравных отношениях. Поскольку оптические изомеры обладают одинаковыми химическими свойствами, то в химических реакциях в отсутствие асимметрического воздействия они всегда образуются или расходуются в равных количествах.
Возникает вопрос: какое значение для органической химии имеет явление оптической изомерии? Дело заключается в том, что многие вещества, синтезируемые животными, растениями, микроорганизмами, обладают оптической активностью и часто представляют собой лишь один оптический изомер. Например, аминокислоты, из которых образованы белки у всех животных и растений нашей планеты – это L-изомеры. Большинство углеводов, которые млекопитающие могут усваивать - это D-изомеры. Многие лекарственные препараты оказывают свое действие лишь при условии их применения в виде одного из оптических изомеров. Поэтому в настоящее время получение органических соединений в виде отдельных оптических изомеров (асимметрический синтез) является одной из важных задач органической химии.
|
|
Соотношение между оптическими изомерами в ходе химической реакции может измениться лишь в том случае, если один из реагентов специфичен по отношению к определенным оптическим изомерам. Таковы многие природные катализаторы химических реакций (ферменты), которые избирательно осуществляют превращения лишь одного из оптических изомеров.
Конформации
Молекулы одного и того же вещества могут существовать в виде различных конформаций. Конформации – различные пространственные формы, возникающие при изменении относительной ориентации отдельных частей молекулы в результате внутреннего вращения атомов или групп атомов вокруг простых связей (вращение вокруг кратных связей невозможно), изгиба связей др.. При этом стереохимическая конфигурация молекулы остается неизменной. Конформации молекулы различаются по энергии, например, заторможенная конформация молекулы этана имеет минимальную энергию, а заслоненная - максимальную, и поэтому подавляющее большинство молекул этана существует в заторможенном виде.

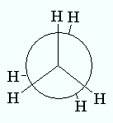
Заслоненная и заторможенная конформации молекулы этана (вид с торца связи С-С).
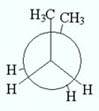
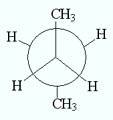
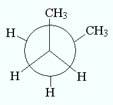
син – конформация, анти -конформация, гош – конформация моелкулы бутана.
Для молекулы циклогексана существует несколько конформаций с низкими (минимальными) значениями энергии, которые называют конформационными изомерами: кресло, ванна, (еще скрученная ванна)

кресло 1 ванна кресло2
Как правило, соединения ряда циклогексана существуют в форме кресла, причем в газовой и жидкой фазах происходит переход между двумя формами «кресло1 ↔ кресло2» с различным расположением боковых заместителей (все аксиальные становятся экваториальными).