1. Лекарственные препараты, производные п – аминофенола.
Производные п – аминофенола в основе химической структуры содержат молекулу анилина. Известно, что анилин, являясь очень токсичным метгемоглобинобразующим веществом, вместе с тем обладает способностью снижать температуру тела. В качестве жаропонижающего средства применялся препарат антифибрин, представляющий собой ацетилированный анилин – ацетанилид. Он имеет меньшую токсичность, но при длительном применении также вызывает отравление, поэтому в настоящее время в медицине не применяется.
Установлено, что образовавшийся в результате гидролиза ацетанилида анилин окисляется в организме до п – аминофенола. Этот процесс можно рассматривать как защитную реакцию организма, т. к. п – аминофенол менее токсичен и сравнительно легко выводится из организма. На основе изучения фармакологического действия производных п – аминофенола были синтезированы малотоксичные препараты. создание новых лекарственных веществ на основе исследования продуктов превращения анилина в организме стало известно под названием «принципа фенацетина».
– Phenacetinum–
1-этокси 4-ацеаминобензол. C10H13O2N М.м. 179,22
OC2H5
 |
NH–C–CH
O
Синонимы: ацетофенетидин, ацетофенелид, фенелин, Фенин и др.
Описание: белый мелкокристаллический порошок без запаха, слегка горького вкуса. Температура плавления 134–1360С. Растворяется в 1400 частях холодной воды, 70 частях кипящей воды и 16 частях спирта, давая нейтральные растворы.
Получение: фенацетин получают из п – нитрохлорбензола, который действием спиртового раствора едкого калия в присутствии медного катализатора переводится в п-нитрофенетол:
CI OC2H5
 |  | ||
 +C2H5OH+KOH + KCI+H2O
+C2H5OH+KOH + KCI+H2O
NO2 NO2
П – нитрофенетол сернистым натрием восстанавливают в п – фенетидин:

 OC2H5 OC2H5
OC2H5 OC2H5
 4 +6Na2S +7H2O 4 +3Na2S2O3 +6NaOH
4 +6Na2S +7H2O 4 +3Na2S2O3 +6NaOH
NO2 NH2
Полученный п – фенетидин перегоняют в вакууме и ацетилируют 80% уксусной кислотой:

 OС2H5 OC2H5
OС2H5 OC2H5
 + CH3COOH +H2O
+ CH3COOH +H2O
NH2 NHCOCH3
По окончании реакции массу выливают в воду, отфильтровывают выпавший технический фенацетин и очищают перекристаллизацией из воды с применением активированного угля.
Испытание на подлинность:
1. Реакция нитрования.
При встряхивании крупинки препарата с разведенной азотной кислотой раствор окрашивается в желтый цвет:
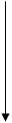

 OC2H5 OC2H5
OC2H5 OC2H5
 +HNO3 +HOH
+HNO3 +HOH
NO2
NHCOCH3 NHCOCH3
А при дальнейшем встряхивании выпадает довольно объемистый осадок 3 – нитро4-ацетаминофенетола.
2. Реакция окисления с дихроматом калия.
Кипятят препарат с разведенной HCI, охлаждают, фильтруют и прибавляют каплю раствора бихромата калия

 K2Cr2O7; при этом появляется сине – фиолетовое окрашивание (п – аминофенол), переходящее в вишнево – красное. Реакция основана на гидролизе и образовании индофенола:
K2Cr2O7; при этом появляется сине – фиолетовое окрашивание (п – аминофенол), переходящее в вишнево – красное. Реакция основана на гидролизе и образовании индофенола:
 H3C2O – – N–C–CH3 HCI H5C2O – --NH2+
H3C2O – – N–C–CH3 HCI H5C2O – --NH2+
H O
+CH3COOH


 H OC2H5
H OC2H5
 H5C2O – --NH2 K2Cr2O7 H5C2O – – N–
H5C2O – --NH2 K2Cr2O7 H5C2O – – N–
NH2
OC2H5
 |  |

 K2Cr2O7 H5C2O – – N= =N – – OC2H5
K2Cr2O7 H5C2O – – N= =N – – OC2H5
NH2
фенетидиновый красный
Непрореагировавший п – аминофенол при взаимодействии с хинонимином образует индофенол:



 NH NH2
NH NH2
 + O= =N – – NH2
+ O= =N – – NH2
O OH
хинонимин п-аминофенол
3. При кипячении с разведенной HCI выделяется CH3COOH, которую можно обнаружить по запаху.

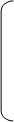

 OC2H5 OC2H5
OC2H5 OC2H5
 + HCI+ HOH +
+ HCI+ HOH +
CI--
NH–C–CH3 NH3+


O
+CH3COOH
4. Реакция образования этилацетета.
При действии на фенацетин конц.H2SO4 при нагревании происходит гидролитическое расщепление как по амидной, так и по простой эфирной связям, в результате чего образуется п – аминофенол, уксусная кислота и этиловый спирт. Уксусная кислота и этиловый спирт образуют уксусноэтиловый эфир.
Методика: осторожно нагревают 1,0 фенацетина с 2 мл конц.H2SO4 до начала кипения, охлаждают и прибавляют 2 мл воды; ощущается запах этилацетата.

 OC2H5 NH2
OC2H5 NH2

 +H2SO4 +CH3COOH+C2H5OH
+H2SO4 +CH3COOH+C2H5OH
NH–C–CH3 OH
O
CH3COOC2H5
 этилацетат
этилацетат
5. Реакция образования иодоформа.
Фенацетин при нагревании с кристаллическим иодом в щелочной среде за счет этоксигруппы образует иодоформ.
 Методика: к 0,02 фенацетина прибавляют кристаллик иода, несколько капель раствора едкого натра и нагревают, образуется иодофрм, обнаруживаемый по запаху.
Методика: к 0,02 фенацетина прибавляют кристаллик иода, несколько капель раствора едкого натра и нагревают, образуется иодофрм, обнаруживаемый по запаху.
 2NH–C–CH3 – – OC2H5 +I2 NaOH 2 CH3I +
2NH–C–CH3 – – OC2H5 +I2 NaOH 2 CH3I +
 O иодоформ
O иодоформ
+2NH–C – – OC2H5 +H2O
Na
6. Реакция с реактивом Марки.
Методика: к 5–10 мл препарата прибавляют 3–5 капель свежеприготовленного реактива марки (1 кап формалина в 1 мл конц.H2SO4), образуется буро – красное окрашивание.
7. Реакция образования азокрасителя.
Методика: 0,02–0,03г препарата кипятят 2–3 мин с 2–3 мл разведенной HCI, охлаждают и добавляют 2–3 кап раствора натрия нитрата, полученный раствор добавляют по каплям к 2 мл щелочного раствора в-нафтола до появления красного окрашивания:

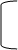


 C2H5O – – NH–C–CH3+HCI OH – – NH+3 CI--
C2H5O – – NH–C–CH3+HCI OH – – NH+3 CI--
O
+CH3COOH
 |  | ||||||||
 |  | ||||||||
 | |||||||||

 OH – – NH3+ CI + NaNO2 OH – – N+=N CI–
OH – – NH3+ CI + NaNO2 OH – – N+=N CI–



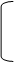 +2H2O+NaCI OH
+2H2O+NaCI OH


 OH – – N+=N CI-- + NaOH HO – – N=
OH – – N+=N CI-- + NaOH HO – – N=
NaO

 =N–
=N–
красное окрашивание
Испытание на чистоту
1. Препарат не должен содержать примесей ацетанаилида (при действии бромной воды не должно быть осадка и мути).
2. Не должно быть свободного п-фенетидина (не должно быть розового окрашивания от добавления 0,1Н раствора иода и кипячения этой смеси).
3. Не должно быть п-хлорацетанилида (устанавливается по эталону на хлорид-ион).
4. Сульфатной золы может быть невесомый остаток, который не должен давать реакции на тяжелые металлы выше эталона. (менее 0,1% на 1,0г препарата).
5. примесь 4-аминофенола может быть определена по реакции образования азо-красителя (см. п. 2) или с раствором нитропруссида натрия (голубая окраска).