Ароматические УВ.





 - это УВ, содержание в молекуле одно или несколько бензольных колец.
- это УВ, содержание в молекуле одно или несколько бензольных колец.









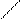 Согласно современным представлениям молекула бензола – это плоский шестичленный цикл, в котором расстояние между всеми атомами «С» одинаковы и равны 0, 140 нм => все связи одинаковы. Все атомы бензола находятся в состоянии sp2 – гибридизации. Это значит, что каждый атом «С» за счёт трёх гибридных орбиталей образует три s - связи, которые лежат в одной плоскости и имеют валентный угол 1200 => молекула бензола плоская. Четвёртая негибридная p – атомная орбиталь, которая сохраняет форму правильной восьмёрки, расположена в пространстве перпендикулярно плоскости цикла – т. е. плоскости, в которой лежат все гибридные орбитали.
Согласно современным представлениям молекула бензола – это плоский шестичленный цикл, в котором расстояние между всеми атомами «С» одинаковы и равны 0, 140 нм => все связи одинаковы. Все атомы бензола находятся в состоянии sp2 – гибридизации. Это значит, что каждый атом «С» за счёт трёх гибридных орбиталей образует три s - связи, которые лежат в одной плоскости и имеют валентный угол 1200 => молекула бензола плоская. Четвёртая негибридная p – атомная орбиталь, которая сохраняет форму правильной восьмёрки, расположена в пространстве перпендикулярно плоскости цикла – т. е. плоскости, в которой лежат все гибридные орбитали.
Негибридные p – атомные орбитали перекрываются своими боками НАД и ПОД плоскостью бензольного кольца с соседними р – атомными орбиталями. А так как между всеми атомами «С» расстояние одинаковое, то и области перекрывания тоже одинаковы => в молекуле бензола нет отдельных (локализованных) π – связей, а есть единая общая (делокализованная) для всех атомов «С» замкнутая 6р – электронная система. Таким образом, в молекуле бензола между атомами «С» нет ни одинарных, не двойных связей, а все связи имеют промежуточный характер – эти связи называют ПОЛУТОРНЫМИ или АРОМАТИЧЕСКИМИ.
 | |||
 | |||
или
С ------- С полуторная (ароматическая) связь.
lС ------ C = 0,140 нм.
Е С ------ С = 460 кДж/моль.
Т.О. для бензола характерен π, π – мезомерный эффект. Такое строение объясняет почему для ароматических УВ характерны р. замещения, а не присоединения. При протекании р.замещения(S)ароматическое кольцо не реагирует => не надо тратить дополнительную энергию, а протекание р. присоединения невозможно без разрушения ароматической системы.

 Гомологический ряд. Номенклатура.
Гомологический ряд. Номенклатура.
1. С6Н6 циклогексатриен – 1,3,5 или бензол.
2. 
 С7Н8 СН3 метилциклогексатриен – 1,3,5 толуол.
С7Н8 СН3 метилциклогексатриен – 1,3,5 толуол.
 |
3. 
 С8Н10 СН3
С8Н10 СН3

 СН3
СН3
а) 1,2 – диметил – ц – гексатриен – 1,3,5, О – кси
лол

 СН3 СН3
СН3 СН3



 б) М – ксилол в) П – ксилол
б) М – ксилол в) П – ксилол

 СН3 мета пара
СН3 мета пара
СН3

 Г) СН2 – СН3
Г) СН2 – СН3
Этилбензол
 Ароматические радикалы называют арилы (Ar.)
Ароматические радикалы называют арилы (Ar.)



 СН2 –
СН2 –
Фенил бензил
- С6Н5
Важнейшие ароматические соединения:
 Н3С – СН – СН3
Н3С – СН – СН3

 Изопропилбензол, кумол
Изопропилбензол, кумол
 СН = СН2
СН = СН2
 винилбензол, стирол (СН2 = СН – винил, непредельный R)
винилбензол, стирол (СН2 = СН – винил, непредельный R)
Изомерия.
1) Изомерия положения боковых цепей (3а, 3б, 3в)
2) Число боковых цепей (3а,3г)
3) Изомерия строения боковых цепей.
Взаимное влияние атомов в молекуле толуола.


 1) Влияние бензольного кольца на СН3 – группу. СН3 группа проявляет положительный индуктивный эффект (+J), а бензольное кольцо – отрицательный (-J), т.е. связь между бензольным кольцом и СН3 – группой становится более прочной. В результате СН3 – группа способна превращаться (окисляться) в карбоксильную группу – СООН. По этой причине радикальное окисление толуола и других гомологов бензола идет легче, чем у алканов:
1) Влияние бензольного кольца на СН3 – группу. СН3 группа проявляет положительный индуктивный эффект (+J), а бензольное кольцо – отрицательный (-J), т.е. связь между бензольным кольцом и СН3 – группой становится более прочной. В результате СН3 – группа способна превращаться (окисляться) в карбоксильную группу – СООН. По этой причине радикальное окисление толуола и других гомологов бензола идет легче, чем у алканов:
 СН3 С = О
СН3 С = О



 [О] ОН
[О] ОН
 Бензойная кислота
Бензойная кислота
толуол
2) Влияние СН3 – группы на бензольное кольцо
В молекуле толуола проявляется s,π – мезомерный эффект (СН3 группа проявляет +J), в результате которого:
1)Увеличивается электронная плотность в бензольном кольце. 2)Происходит перераспределение эл. плотности внутри бензольного кольца – она увеличивается в положении 2,4,6 или в орто -, пара – положении. В эти положения идут реакции электрофильного замещения (SE).
В результате толуол легче вступает в реакции замещения, чем бензол.
Физические свойства.
Бензол и его гомологи в обычных условиях токсичные жидкости с характерным неприятным запахом. Плохо растворяются в воде, хорошо – в органических растворителях.
Получение.
I. В промышленности (УВ уголь, нефть).
1) Из нефти - дегидрирование циклоалканов 
2) Дегидроциклизация алканов (ароматизация)
II В лаборатории
1) 


 р. Дюма – декарбоксилирование натриевых солей ароматических кислот. О
р. Дюма – декарбоксилирование натриевых солей ароматических кислот. О



 С – О – Na
С – О – Na
 + NaО Н CuO, t + Na2CO3
+ NaО Н CuO, t + Na2CO3
2) Циклическая тримеризация алкинов
 3С2Н2 Сакт, 450 С6Н6
3С2Н2 Сакт, 450 С6Н6
Способы получения гомологов бензола.
1) р. Вюрца – это действие металлического Na на смесь предельных и ароматических галогенопроизводных и ароматических галогенопроизводных



 Cl C2H5 этилбензол
Cl C2H5 этилбензол


 + 2Na + Cl – C2H5 + 2NaCl
+ 2Na + Cl – C2H5 + 2NaCl





C2H5 – C2H5 + 2NaCl дифенил + 2NaCl
бутан
2) р. Фриделя – Крафта – это реакция алкилирования бензола и его гомологов галогеналканами, алкенами или спиртами в присутствии катализаторов (AlCl3, H3PO4, H2SO4).


 а) алкилирование галогеналканами:
а) алкилирование галогеналканами:







 Нδ+ Clδ- СН СН3 CH – CH3
Нδ+ Clδ- СН СН3 CH – CH3
 + СН AlCl3 CH3 + HCl
+ СН AlCl3 CH3 + HCl
2-хлорпропан кумол (изопропилбензол)
б) алкилирование алкенами:

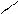


 Нδ+ СН – СН2 – СН3
Нδ+ СН – СН2 – СН3

 + δ-СН2 = СНδ+ - СН2 – СН3 Н3РО4 СН3 вторбутилбензол
+ δ-СН2 = СНδ+ - СН2 – СН3 Н3РО4 СН3 вторбутилбензол
Бутен – 1
 в) алкилирование спиртами:
в) алкилирование спиртами:

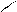




 Нδ+ С2Н5
Нδ+ С2Н5


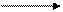 + НОδ- С2Н5 Н2SO4 этилбензол
+ НОδ- С2Н5 Н2SO4 этилбензол
 этанол
этанол
Химические свойства.
Арены характеризуются свойствами – ароматичностью – это способность циклических плоских, ненасыщенных систем с делокализованными π – е вступать в реакции замещения (S), а не присоединения (А).
I SЕ - электрофильное замещение
1. Галогенирование (в присутствии катализаторов – галогенидов Fe(III) или Al(кислоты Льюиса)).
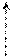


 δ- Нδ+ Cl
δ- Нδ+ Cl

 + Clδ+: Clδ- AlCl3 + HCl
+ Clδ+: Clδ- AlCl3 + HCl
E хлорбензол
 CH3 CH3 CH3
CH3 CH3 CH3







 Hδ+ Hδ+ Br
Hδ+ Hδ+ Br
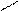



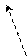
 + Brδ+: Brδ- FeBr3 + + 2HBr
+ Brδ+: Brδ- FeBr3 + + 2HBr

Hδ+ Е о - бромтолуол Br n - бромтолуол
2. Реакция нитрования (взаимодействие с нитрующей смесью HNO3 конц. , H2SO4 конц).


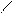
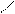

 Н NO2
Н NO2
 + НО – NO2 H2SO4 + H2O
+ НО – NO2 H2SO4 + H2O
Бензол нитробензол

 Легче: у гомологов бензола. СН3 NO2
Легче: у гомологов бензола. СН3 NO2


 СН3 + HO – NO2
СН3 + HO – NO2






 Н + НО – NO2 H2SO4 CH3о-нитротолуол
Н + НО – NO2 H2SO4 CH3о-нитротолуол

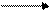
 п- нитротолуол + HO – NO2
п- нитротолуол + HO – NO2
NO2
3. Алкилирование (р. Фриделя - Крафтса). Это р. алкилирования бензола и его гомологов галогеналканами, алкенами, спиртами (см. способы получения гомологов бензола).
II. SR (для гомологов бензола) протекает при действии hn или высокой t.


 СН3
СН3
 + Br2 t C6H5 CH2Br + HBr
+ Br2 t C6H5 CH2Br + HBr
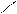

 Толуол СН2 –
Толуол СН2 –
(радикал или С6Н5 – СН2 – называют бензил).
 СН3
СН3

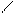

 СН – СН3 CH3 – CBr – CH3
СН – СН3 CH3 – CBr – CH3


 + Br2 hn + HBr
+ Br2 hn + HBr
Кумол (изопропилбензол)
III. Реакция присоединения (АR) – доказательство ненасыщенности ароматических УВ.
1.  Галогенирование Cl
Галогенирование Cl

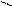
 Cl Cl
Cl Cl

 + 3Ci2 hn Cl Cl 1,2,3,4,5,6 - гексахлорциклогексан
+ 3Ci2 hn Cl Cl 1,2,3,4,5,6 - гексахлорциклогексан
Cl
2. 
 Гидрование
Гидрование
 + 3Н2 Т, Ni(Pt)
+ 3Н2 Т, Ni(Pt)
циклогексан
IV. Окисление
Бензол устойчив к действию окислителя как на холоду, так и при нагревании.
Гомологи бензола окисляются значительно легче за счёт боковой цепи, причём при действии сильных окислителей (KMnO4,K2Cr2O7) в кислой среде при нагревании боковая цепь независимо от длины и строения превращается в карбоксильную группу СООН. Таким образом, всегда образуется бензойная кислота.


 СН3 С = О
СН3 С = О


 [О] ОН
[О] ОН
Толуол бензойная к-та
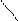 С6Н5 – СН3 + КMnO4 +H2SO4 C6H5 – C = O + MnSO4 + K2SO4 + H2O
С6Н5 – СН3 + КMnO4 +H2SO4 C6H5 – C = O + MnSO4 + K2SO4 + H2O
бензойная кислота OH
Горение
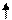
 2С6Н6 + 15О2 12СО2 + 6Н2О
2С6Н6 + 15О2 12СО2 + 6Н2О