Теория кислот и оснований Аррениуса. Протолитическая терия кислот и оснований Бренстеда-лоури. Кислоты и основания Льюлиса.
Согласно теории Аррениуса: кислотой при диссоциации которого образуются катионы водорода основанием диссоциации которого образуется гидроксид-ион. Амфолитом (амфотерным гидроксидом), диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид – ионов.
Протонная теория кислот и оснований Бренстеда-Лоури
Кислотой называют любое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т.е. быть донором протонов;
Типы:
1)Нейтральные- HCl, H2SO4, H3PO4
2)Катионные- р NH4+, Н3О+
3)Анионные- HSO4-, H2PO4-, HPO42
основанием называют вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов
Типы:
1) Нейтральные- NH3,Н2О, С2Н5ОН
2) Катионные- Н2N−NH3+.
3) Анионные - Cl-, СН3СОО-, ОН-:
Теория Льюиса (электронная теория).
кислотой называют вещество, принимающее неподеленную электронную пару, - акцептор электронов. трихлорида брома и оксида серы (VI), галогениды бора, АL.
основанием называют вещество, поставляющее электроны для образования химической связи, - донор электронов. молекулы аммиака и воды. ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R- органический радикал).
Ионное произведение воды и водородный показатель.
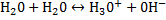
Вода это слабый электролит
Концентрацию молекул воды [H2O], то есть число моль в 1 л воды можно считать постоянной и равной [H2O] = 1000 г/л: 18 г/моль = 55,5 моль/л. Получаем
К´[H2O] = К(H2O) = [H+]×[OH-] = 10-14 (22°С)
Произведение концентраций [H+] и [OH-], то есть ионное произведение воды, есть величина постоянная и равная 10-14 при 22°С: [H+]×[OH-] = 10-14
[H+] =10-7= [OH-] - нейтральная среда
[H+] >10-7> [OH-] - кислая среда
[H+] <10-7< [OH-] - щелочная среда.
Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода рН = - lg[H+]. это мера активности ионов водорода в растворе, количественно выражающая его кислотность,
Буферные растворы. Механизм действия буферных растворов. Назначение и применение.
Буферным раствором называют раствор способный поддерживать постоянное значение Ph.
Типы:
а) Кислотные
б) Основные
в) Белковые
Растворы применимые в Анализе: Формиатный раствор 3,8(смесь муравьиной кислоты и её соли натрия), Ацетатный раствор4,7 (смесь уксусной кислоты и её соли), Аммиачный раствор 9,25 (аммиак и хлорид аммония)
Механизм. Одна составная часть раствора способна взаимодействовать с н+ кислот, а другая с ОН- основания. То есть связывать эти ионы.+
Произведение растворимости. Вывод формул
Протекание взаимно противоположных процессов приводит к состоянию динамического равновесия,где скорость осаждения ионов становится равной скорости растворения.

Константа ПР характеризует способность электролита растворятся и ровняется произведению активностей ионов в растворе.
Влияние одноимённых и других ионов на растворимость электролитов, солевой эффект.
При установлении динамического равновесия скорость осаждения равна скорости растворения. Получается насыщенный раствор, где произведение концентрации ионов равно произведению растворимости.
Если к насыщенному раствору электролита прилить раствор другого электролита имующий общий или одноимённый ион, то произведение концентрации ионов превысит произведение растворимости, раствор станет перенасыщенным, а перенасыщенный раствор выделяет част электролита в виде осадка. Пример CaSО4 + H2SO4 в осадок выпадет соль кальция.
Солевым эффектом называется повышение растворимости малорастворимых электролитов в системе осадок-раствор при добавления другого сильного электролита.
Солевой эффект обусловлен уменьшением коэффициентом активности в следствии повышением ионной силы раствора при проливании иного электролита.