Называют реакцию обмена между водой и солью растворённую в ней
Гидролиз сои образованной:
А) сильной кислотой и сильным основанием – не протекает
Б) слабой кислоты и сильного основания-СН3СОO- + H2O «СН3СООH + ОН- -Среда щелочная
В)сильной кислотой и слабым основанием- NН4++Н20 «NН40Н + Н+ ---кислая среда
Г) слабой кислотой слабым основанием- NН4++Н20 «NН40Н + Н+ F- + Н20 «НF + OН-
Степень гидролиза β=Сгидрализоваггых/С
Степень выражает отношение гидролизованный части ко всей
Когстанта выражает отношение продуктов к негидролизированной части

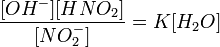

В анализе используются реакции гидролиза на определение сульфидоф металов. Характерная реакция на определения хлорида берилия
13. Комплексонообразование, теория Вернера, номенклатура. Диссоциация комплексных соединений.
Комплексные соединения – вещества, молекулы которых состоят из внутренней сферы (комплексные ионы) - центрального атома или иона металла (комплексообразователя) непосредственно связанного с определенным (координационным - кч) числом других молекул или ионов (лигандов), и внешней сферы – ионов противоположного знака. К[MeLn], [MeLn]A.
- Сначала называют анион, а затем катион.
- Если лиганд является кислотным остатком, то к его названию добавляют приставки, указывающие на их число, и окончание «о». Затем называют нейтральные лиганды, добавляя приставки, указывающие на их число.
- Далее называют ион комплексообразователя с указанием степени окисления (на письме обозначается римскими цифрами в круглых скобках). В анионных комплексах к названию комплексообразователя добавляют суффикс «ат». В катионных комплексах даются латинские названия ионам металлов.
Например: [Cu(NH3)4](OH)2– гидроксид тетраамминмеди (II);
K[Fe(NH3)2(CN)4] – тетрацианодиамминферрат (III) калия;
[Co(NH3)6]Cl3– хлорид гексаамминкобальта (III).
Теория была создана в 1893г.
Комплексные соединения характеризуются наличием центрального иона – комплексообразователя (d– элементы:Fe,Co,Cu,Zn,Mo,Mn; режеp– элементы:Al,Sn,Pb; изs– элементов толькоLi).
Центральный ион окружен лигандами, в качестве них могут быть частицы, имеющие свободную пару электронов (Н2О:,:NH3,:Cl-). Число лигандов определяется координационным числом, которое обычно в два раза больше, чем степень окисления комплексообразователя.
Комплексообразователь и лиганд образуют внутреннюю сферу комплекса, заряд которой определяется как алгебраическая сумма зарядов всех комплексообразователей и лигандов. [Co+3(NH3)60]+3Cl3-.
В состав внешней сферы входят ионы противоположного знака.с
Диссоциирует на комплексный ион и ион внешней сферы. Далее комплексообразователь снова диссоциирует.
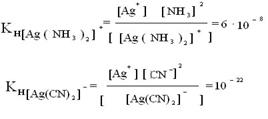
14. Сущность гравиметрического анализа, классификация методов.
Гравиметрический (весовой) анализ - это один из методов количественного анализа, основанный на определении массы искомого компонента анализируемого образца путем измерения —точного взвешивания —массы устойчивого конечного вещества известного состава, в которое полностью переведен данный определяемый компонент.
методы осаждения, отгонки, выделения, термогравиметрические методы
Осаждения - Сущность их состоит в следующем. Определяемый компонент раствора вступает в химическую реакцию с прибавляемым реагентом —осадителем, образуя малорастворимый продукт — осадок, который отделяют, промывают, высушивают (при необходимости прокаливают) и взвешивают на аналитических весах.
Отгонка - Определяемый компонент выделяют из анализируемой пробы в виде газообразного вещества и измеряют либо массу отогнанного вещества(прямой метод),либо массу остатка(косвенный метод).
Выделение - Определяемый компонент выделяют (обычно из раствора), например, при электролизе на одном из электродов (электрогравиметрический метод). Затем электрод с выделившимся веществом промывают, высушивают и взвешивают.
Термогравиметрические методы. Эти методы основаны на измерении массы анализируемого вещества при его непрерывном нагревании в заданном температурном интервале (чаще всего от комнатной температуры до заданной).