Номенклатура и изомерия.
Определение: Органические соединения, состоящие из атомов углерода и водорода - называются углеводородами.
Предельными насыщенными углеводородами, алканами - называются органические соединения построенные из атомов углерода и водорода, в молекулах которых каждый атом углерода соединен с соседним атомом углерода не более чем одной связью (одной валентностью). Валентности, не затраченные на соединение с атомами углерода насыщенны водородом. Все атомы углерода находятся в состоянии sр3-гибридизации.
Предельные углеводороды образуют гомологический ряд с общей формулой СnН2n+2. Родоначальником гомологического ряда алканов является метан. Первые десять членов гомологического ряда алканов:
Метан, этан, пропан, бутан, пентан, гексан. гептан, октан, нонан, декан.
Атом углерода в молекуле алкана, соединенный с не более чем одним соседним атомом углерода – называется первичным. Атом углерода в молекуле алкана, соединенный с не более чем двумя соседними атомомами углерода – называется вторичным. Атом углерода в молекуле алкана, соединенный с не более чем тремя соседними атомами углерода – называется третичным. Атом углерода в молекуле алкана, соединенный с четырьмя соседними атомами углерода – называется четвертичным.

Для алканов характерна структурная изомерия. Начиная с бутана – четвертого члена гомологического ряда одной молекулярной формуле могут соответствовать несколько структур:

У бутана могут существовать два изомера, у пентана – три, у гексана – пять и т. д. Число изомеров для любого гомолога можно вычислить по формуле, если известно число изомеров у предшествующего члена гомологического ряда.
Строение молекул изомерных соединений можно представить как углеродный остов, к которому присоединены одновалентные группы или остатки молекул алканов. Такие остатки носят особое название.
Определение: Остаток молекулы алкана после отнятия атома водорода называется радикалом. В данном случае алкил или алкильный радикал.
Одновалентные радикалы называется по исходной молекуле алкана. При этом суффикс «ан» предельных углеводородов - заменяется на «ил». Например:
 В зависимости от того, какой атом несет неспаренный электрон различают первичные, вторичные и третичные радикалы. Неразветвленный первичный радикал называют нормальными и обозначают строчной буквой «н -».
В зависимости от того, какой атом несет неспаренный электрон различают первичные, вторичные и третичные радикалы. Неразветвленный первичный радикал называют нормальными и обозначают строчной буквой «н -».
Многообразие структур органических соединений отражает номенклатура – система названий, в которой каждому названию соответствует только одно соединение.
Номенклатура.
В органической химии три номенклатуры. Но каждому названию должно соответствовать.
1. Тривиальная номенклатура – это система исторически сложившихся названий, но применяемых до настоящего времени. Эти названия даны в ранний период развития органической химии и не отражают строение молекул. Примерами тривиальных названий являются названия первых четырех членов гомологического ряда алканов.
2. Строение молекул учитывает рациональная номенклатура. За основу названия органического соединения принимается название первого члена гомологического ряда. Остальные соединения рассматриваются как его производные, в которых атомы водорода замещены на алкильные радикалы. Например:

Алкильные радикалы перечисляются в порядке возрастания массы. Радикал нормального строения старше радикала изомерного строения. Если замещающих радикалов больше одного, то их количество обозначается префиксами ди - три - тетра -.
По мере роста количества соединений использование рациональной номенклатуры стало неудобным, и химики перешли к рассмотрению уже атома или группы атомов, а структуру, сформированную цепью углеродных атомов.
3. Рассмотрение наибольшей цепи проводится в систематической номенклатуре. Основы систематической номенклатуры были заложены на съезде химиков в 1892г в Женеве. Что дало основу для названия номенклатуры – женевская. Усовершенствована систематическая номенклатура была на съезде в 1930г в Льеже. Появилась Льежская номенклатура. Современный вариант систематической номенклатуры принят международным союзом по теоретической и прикладной химии (IUPAC) в 1957г. и усовершенствован в 1965г.
Для того чтобы назвать органическое соединение по систематической номенклатуре необходимо:
- выбрать самую длинную (главную) цепь;
- определиться со старшинством групп;
- пронумеровать главную цепь, придавая старшей группе наименьший из номеров локантов;
- перечислить префиксы;
- составить полное название соединения.
Примеры:

Способы получения.
Все способы получения делятся на промышленные и лабораторные.
Природные источники и промышленные способы получения алканов.
1. Предельные углеводороды с небольшим числом углеродных атомов (до 11) выделяют из природного газа или бензиновой фракции нефти. Основным способом переработки нефтяных фракций являются различные виды крекинга. Крекинг – это термическое разложение углеводородов и других составных частей нефти.
2. По методу Фишера-Тропша алканы можно получать каталитичеким гидрированием окиси и двуокиси углерода:

3. Каталитическая гидрогенизация угля. Получила название «ожижение» угля. Твердый каменный уголь в ходе этого процесса превращают в смесь алканов. Эта реакция лежит в основе производства синтетического бензина:

Лабораторные способы получения алканов.
1. Предельные углеводороды, начиная с пентана, наиболее часто получают в лабораторных условиях каталитическим гидрированием непредельных углеводородов с тем же числом углеродных атомов и таким же строением цепи:

В качестве катализатора используют мелкодисперстные Рt, Pd, Ni. Процесс проводят при обычных температуре и давлении.
2. Предельные углеводороды в лабораторных условиях получают восстановлением галогенпроизводных действием цинка в водном растворе минеральной кислоты или уксусной кислоты:

При использовании в качестве субстрата йодистых алкилов можно получить алкан восстановлением йодистоводородной кислоты:
 3. Синтез предельных углеводородов из соединений с меньшим числом углеродных атомов осуществляется действием натрия на галогенпроизводные – реакция Вюрца:
3. Синтез предельных углеводородов из соединений с меньшим числом углеродных атомов осуществляется действием натрия на галогенпроизводные – реакция Вюрца:

Особенностью синтеза Вюрца является то, что в случае использования в качестве исходных веществ различных галогеналкилов в результате реакции получается смесь трех углеводородов:

4. Общим способом получения углеводородов является декарбоксилирование карбоновых кислот:

Насыщенные углеводороды в ряде случаев удобнее получать нагреванием натриевой соли карбоновой кислоты с избытком едкого натра:

При нагревании натриевой соли карбоновой кислоты с едким натром получается углеводород с числом атомов углерода равным числу атомов углерода в радикале кислоты. Углеводород с удвоенным количеством атомов углерода получается при электролизе натриевой соли карбоновой кислоты:

Физические свойства и строение.
Физические свойства
Физические свойства алканов, как и всех других органических соединений определяются их составом и строением. Низшие алканы С1-С4 при нормальных находятся в газообразном состоянии. Линейные алканы С5-С15 являются жидкостями. Температуры кипения в гомологическом ряду возрастают, причем разность температур кипения ближайших гомологов все время уменьшается. (Относительное уменьшение изменения кинетической энергии). Изомеры с нормальной цепью углеродных атомов кипят при более высокой температуре, чем углеводороды с разветвленной цепью. Причина в меньшем взаимодействии между молекулами с разветвленной цепью. Ответвления от главной цепи создают пространственные препятствия для сближения молекул. Температуры плавления в гомологическом ряду предельных углеводородов медленно возрастают. При этом предельные углеводороды образуют два ряда. Один для гомологов с четным числом углеродных атомов в цепи. Другой – для гомологов с нечетным числом углеродных атомов. Температуры плавления у четных гомологов обычно выше, чем у нечетных. Объяснение данному факту дано из рассмотрения пространственного расположения. Молекулы с четным числом атомов углерода построены симметрично и плотнее упакованы в кристаллической решетке. Поэтому на разрушение более плотной упаковки необходимо затратить больше энергии, что выражается в больших температурах плавления.
Плотность предельных углеводородов вначале быстро, а затем все медленнее возрастает до 0.78.
Предельные углеводороды – вещества неполярные (аполярные) и трудно поляризуемые. Растворимость в воде очень малая.
4.2. Пространственное строение.
Межатомные расстояния и валентные углы в молекулах алканов являют собой стандарт и соответствуют строению правильного тетраэдра. Валентный угол между любыми двумя связями составляет 109028¢, а длина σ-связи между атомом углерода в состоянии sp3-гибридизации и атомом водорода равна 0.1085нм или 1.085А0:

Пространственное строение гомологов в ряду алканов определяется возможностью свободного вращения фрагментов их молекул относительно друг –друга. При таком вращении молекула приобретает определенное пространственное строение, которое называется конформацией.
Определение: Конформациями молекулы определенной конфигурации называются состояния молекулы с различным расположением ее атомов в пространстве, возникающие в результате вращения вокруг связей.
Конформации различаются между собой стабильностью. Более стабильные конформации, которые фиксируются физико-химическими методами, называются конформерами.
Определение: Конформер – это молекула в такой конформации, в которую атомы самопроизвольно возвращаются после небольших сдвигов. Конформеры являются конформационными изомерами. В отличии от структурных изомеров они имеют одинаковые структурные формулы. В отличие от оптических изомеров, могут быть совмещены друг с другом. Различаются конформеры только степенью поворота фрагментов молекулы относительно одной или нескольких σ-связей. Например конформации молекулы этана изображенные двумя способами:

Перспективные проекции (проекции Ньюмена и типа «лесопильные козлы») основаны на тетраэдрическоой конфигурации атомов углерода в молекулах алканов. При построении проекций выбирают центральную С-С связь, относительно которой вращаются два фрагмента молекулы. Атомы углерода этой С-С связи в перспективных проекциях изображают в виде точек. В проекциях Ньюмена центральная С-С связь располагается перпендикулярно плоскости чертежа. Задний атом углерода изображают в виде круга, а передний - в виде точки в центре круга.
Две конформации этана, показанные выше, больше других различаются по энергии между собой. Эти конформации получили название «заслоненная» и «заторможенная».
Определение: Заслоненной конформацией – называют конформацию, в которой группы соседних атомов находятся одна за другой. При этом двугранный угол между заместителями, находящимися у соседних атомов углерода равен 00.
Определение: Заторможенной конформацией – называют конформацию, при которой двугранный угол между заместителями, находящимися у соседних атомов углерода равен 600.
Определение: Барьер вращения фрагментов молекулы – это энергия, которая необходима для перехода молекулы из одной конформации в другую.
Например барьер вращения при переходе заторможенной конформацииэтана, которая является наиболее устойчивой, в заслоненной конформацию, которая является наименее устойчивой – равен разности свободных энергий каждого из двух состояний и составляет 12.6 кДж/моль, около 3 ккал/моль. Исходя из величины барьера энергию взаимодействия каждой, из трех пар соседних С-Н связей, может быть оценена в 1 ккал/моль или 4 кДж/моль. Больший запас энергии молекулы этана в заслоненной конформации обусловлен отталкиванием С-Н связей у соседних атомов углерода, двугранный угол между которыми, равен 00.
Те же эффекты определяют энергии барьеров вращения в средних и высших алканах.
Большее число конформационных переходов, чем в этане, претерпевает молекула н- бутана. Для нее возможны шесть конформаций. В том числе добавляется новая: гош - или скошенная конформация, а заторможенную конформацию в этом случае называют анти - конформация.
5. Химические свойства.
Химические превращения предельных углеводородов могут протекать либо после гомолитического разрыва углерод-углеродных связей, либо за счет отрыва атомов водорода, также обычно гомолитического, и последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления и замещения.
Расщепление молекулы алкана по σ-связи С-С требует 350 кДж/моль. Расщепление -связи С-Н требует 340 - 420 кДж/моль. Т.е. связь углерод-углерод является менее прочной и, казалось бы, реакции должны предпочтительно идти по связи С-С. Однако реакции чаще идут с расщеплением связей С-Н, поскольку эти связи находятся на периферии молекулы и более доступны атаке реагентами.
Наряду с доступностью связей действуют и другие факторы, определяющие реакционную способность алканов. Например, по энергии связи С-Н различаются в зависимости от того с каким атом углерода соединен атом водорода. По энергии связи С-Н формируют следующий ряд:

Энергия химической связи относится к разряду так называемых статических факторов, определяющих реакционную способность. На ряду со статическими - действуют динамические факторы. В частности в приложении к алканам действует фактор стабильности свободных радикалов.
Определение: Свободными радикалами называются частицы, имеющие один или несколько неспаренных электронов. Наибольшее значение в органической химии имеют свободные радикалы с неспаренным электроном на атоме углерода. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а, следовательно, имеет плоскостное строение:

Если радикалы R1, R2 и R3 являются алкильными радикалами, то возможно взаимодействие (перекрывание) орбитали, на которой находится неспаренный электрон, со связями С-Н:

Такое взаимодействие называется сверхсопряжением или гиперконьюгацией. За счет сверхсопряжения неспаренный электрон получает приток электронной плотности с противоположным спином, что способствует его стабилизации. Из этой схемы следует, что чем больше алкильных заместителей у атома, несущего неспаренный электрон, тем более устойчивым является радикал. Соответственно радикалы формируют следующий ряд стабильности:

Ряд стабильности радикалов может иметь другое объяснение. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а алкильные радикалы построены из атомов углерода в состоянии sp3-гибридизации. Поэтому атом углерода, несущий неспаренный электрон является более электроотрицательным, чем атомы углерода заместителей. Соответственно происходит смещение электронной плотности по системе σ-связей к атому, несущему неспаренный электрон. Чем больше будет заместителей, тем больше электронной плотности будет смещено к радикалу, тем выше его стабильность:

Совокупность статических и динамических факторов определяет характер и направление протекания реакций. В том числе реакций радикального замещения у насыщенного атома углерода. Реакции радикального замещения обозначаются символом SR.
Примеры реакций.
1. Галогенирование.
Замещение водородных атомов на атомы галогенов является одной из наиболее характерных реакций предельных углеводородов. Предельные углеводороды вступают в реакцию со всеми галогенами. Причем реакционная способность (скорость галогенирования) снижается в ряду фтор > хлор > бром > йод.
1.1. Фторирование.
Предельные углеводороды со свободным фтором реагируют со взрывом. Реакции идут очень быстро с большим выделением тепла (горят). Разбавление фтора азотом или применение растворителей, в качестве которых используют полностью фторированные углеводороды, позволяет получать полифтрорированные углеводороды:

Фторированные углеводороды можно получить с использованием трифторида кобальта.
1.2. Хлорирование.
Хлор реагирует с насыщенными углеводородами только под влиянием света, нагревании (3000С) или в присутствии катализаторов. Причем последовательно замещаются хлором все атомы водорода. При хлорировании наиболее легко замещаются атомы водорода у третичного атома углерода, что связано с наименьшей энергией связи С-Н и наибольшей стабильностью, радикала, который образуется в ходе реакции. В ходе реакции образуются продукты замещения у всех атомов углерода. Соотношение между скоростями реакции замещения водородных атомов при первичном, вторичном и третичном равно 1: 3.25: 4.3.
При термическом хлорировании также образуется смесь различных продуктов хлорирования.
Катализаторами реакции, как правило, являются вещества, образующие при температуре реакции свободные радикалы.
Для выяснения роли радикалов в ходе реакции галогенирования, в частности хлорирования, рассмотрим ее механизм.
Определение: Механизм реакции – совокупность последовательных стадий, приводящая к образованию продуктов из заданных реагентов.
Исследования реакции хлорирования метана или реакции металепсии показали, что эта реакция имеет цепной, радикальный механизм и включает основные три стадии.
1. Зарождение цепи.
На этой стадии под действием кванта света молекула хлора распадается на два радикала:

2. Рост цепи:
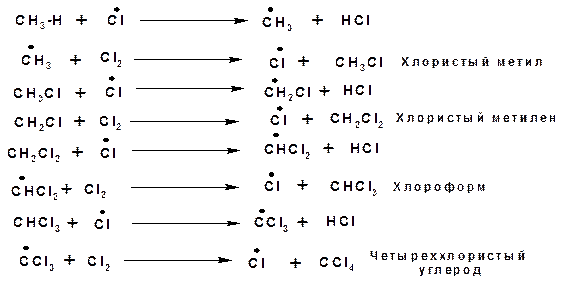
3.. Обрыв цепи:

По ходу реакции можно определить тепловой эффект реакции:
Разрыв молекулы хлора на атомы под действием
фиолетового света, или температуры 3000С 242.8 кДж/моль
Разрыв связи С-Н 427.1 кДж/моль
Образование связи С-Сl -347.5 кДж/моль
Знак «-» означает выделение энергии
Образование связи Н-Сl -431.2 кДэж/моль
Энергетический баланс реакции - 108.8 кДж/моль.
1.3. Бромирование.
Реакция бромирования значительно менее экзотермична, чем хлорирование. Причем образование бромистого водорода при росте цепи является эндотермической реакцией. Поэтому скорость роста цепи гораздо ниже, чем при хлорировании. Более медленное течение реакции бромирования способствует более высокой избирательности (селективности) по сравнению с хлорированием. Соответственно в продуктах фотохимического бромирования алканов значительно преобладают продукты, образующиеся при разрыве наименее прочной связи С-Н и протекании реакции через наиболее стабильный радикал:

1.4. Сульфохлорирование.
Сульфохлорирование алканов при УФ-облучении, при комнатной температуре, протекает как цепной радикальный процесс (реакция Руффа). В качестве продуктов образуются хлорангидриды алкансульфокислот. Особенностью реакции является следующее: при наличии в молекуле углеводорода первичных, вторичных и третичных атомов углерода замещению не подвергаются атомы водорода при третичном атоме углерода:

1.5. Нитрование.
Атомы водорода в углеводородах могут быть замещены нитрогруппой -NO2. Соответствующая реакция называется реакцией нитрования. Протекает реакция также по цепному радикальному механизму. Нитрование алканов впервые провел М.И.Коновалов действием 10-20% азотной кислоты при 120-1500С. (реакция Коновалова, 1888г.):

Данная реакция протекает в жидкой (по Коновалову) при 100-1500С, и в газовой фазе при 250-5000С.
В реакцию жидкофазного нитрования вступают все углеводороды, однако продукты образуются с низкими выходами. Наиболее высокие выхода получаются для алканов, имеющих третичные углеродные атомы.
В газовой фазе реакция нитрования сопровождается окислением углеводородов и расщеплением углерод-углеродных связей. Поэтому в продуктах наряду с основными содержатся низкомолекулярные нитроалканы. Так, в случае нитрования пропана образуется 34% 1-нитропропана СН3-СН2-СН2-NO2, 32% 2-нитропропана СН3-СНNO2-СН3, 26% нитроэтана СН3-СН2-NO2, и 8% нитрометана СН3-NO2.
1.4. Окисление алканов.
Наиболее распространенным процессом в химии алканов является их окисление. Как известно алканы составляют основные виды энергоносителей: бензин, дизельное топливо, авиационный керосин, топочный мазут. Сгорание алканов происходит до углекислого газа и воды. Но двуокись углерода и вода это конечные продукты реакции со сложным механизмом, протекающим через стадии образования радикалов и их распада.
В процессе окисления предельных углеводородов в качестве промежуточных продуктов образуются органические гидроперекиси:

Образующиеся в результате распада гидроперекиси радикалы вступают в две реакции.
1. Отрывают атомы водорода от других молекул алканов и дают спирты.
2. Распадаются по β-связи (β по отношению к атому, несущему радикал) с образованием альдегидов и кетонов.
Радикалы третичных гидроперекисей распадаются с образованием третичного спирта или кетона, по схеме:

Радикалы вторичных гидроперекисей, в зависимости от температуры распадаются по двум схемам. При низких температурах образуются, преимущественно, спирты и кетоны:

При высоких температурах преимущественно образуются спирты и альдегиды:

Радикалы первичных гидроперекисей распадаются с образованием первичного спирта альдегида и формальдегида:

1.6. Крекинг углеводородов при высокой температуре.
При температурах 300-7000С предельные углеводороды образуют сложную смесь предельных, непредельных и ароматических углеводородов. Основными процессами при крекинге являются дегидрогенизация и разрыв углеродной цепи. Эти процессы протекают через стадию свободных радикалов.
Свободные радикалы, образующиеся в процессе крекинга, способны к следующим превращениям:
1. Распад по β-связи (β по отношению к атому, несущему радикал). В результате распада образуются алкан и алкен:
R-СН-СН2 R + СН2 = СН2