Буферные системы крови
Нормальное значение рН крови составляет 7,40 ± 0,05. Это означает, что значения активной кислотности а (Н+) должны нахо-диться в интервале от 3,7×10-8 до 4,0×10-8 моль/л. Присутствующие в крови электролиты (НСО3–, Н2СО3, Н2РО4–, НРО42–, белки, аминокис-лоты) диссоциируют в такой степени, что активность а (Н+) находится в рамках приведенного выше диапазона.
Однако в ряде физиологических процессов в кровь поступают вещества в количествах, достаточных для того, чтобы вызвать заметные отклонения рН крови от нормы. Наиболее сложной и часто встречаемой причиной нарушения кислотно-основного равновесия крови является ацидоз. Различают две формы ацидоза: газовую и метаболическую.
Газовая форма ацидоза обычно бывает вызвана увеличением в парциального давления СО2 в плазме крови. Метаболическая форма ацидоза отражает такое состояние, когда кислые метаболиты уже проникли в ткани и вызвали стойкую гипоксию (снижение содер-жания О2). Способы подавления этих форм ацидоза в плазме и клетках крови различны, поэтому целесообразно рассмотреть про-цессы, протекающие в этих составляющих крови, отдельно.
Плазма крови
Кислотно-основное равновесие в плазме крови человека в основном обеспечивается гидрокарбонатной, фосфатной, белковой и аминокислотной буферными системами.
1. Гидрокарбонатная буферная система.
В плазме крови наиболее важной буферной системой в поддер-жании постоянства рН является гидрокарбонатная Н2СО3/НСО3-. Особенность этой буферной системы заключается в том, что один из ее компонентов - угольная кислота Н2СО3 - образуется при взаимо-действии растворенного в воде СО2 с водой:
CO2(р-р) + H2O ⇄ Н2СО3
Концентрация растворенного СО2 определяется равновесием:
CO2(р-р) ⇄ CO2(газ),
которое описывается законом Генри:
 , ,
| (10) |
где S - постоянная Генри [моль/(л∙давление)];
P - парциальное давление CO2, [атм; Па; мм рт. ст.].
Таким образом, в плазме крови устанавливается равновесие:
CO2 + H2O ⇄ Н2СО3 ⇄ H+ + НСО3-
Диссоциация угольной кислоты по первой ступени описывается уравнением:

В стандартных условиях  , соответственно
, соответственно  .
.
Учитывая довольно низкую растворимость CO2 в воде [S = 0,033 ммоль/(л∙мм рт. ст.)], в физиологических условиях весь CO2, растворенный в плазме крови, рассматривают как гидратиро-ванный до Н2СО3, поэтому выражение для  имеет вид:
имеет вид:

Отсюда  .
.
Так как концентрация Н2СО3 в гидрокарбонатной буферной си-стеме зависит от парциального давления СО2 в газовой фазе, значение рН гидрокарбонатного буфера в конечном счете определяется кон-центрацией ионов НСО3- в растворе и парциальным давлением СО2:
 . .
| (11) |
Гидрокарбонатная буферная система действует как эффективный физиологический буфер вблизи рН = 7,4. В этих условиях отношение концентраций компонентов в гидрокарбонатной системе составляет:


Таким образом, в плазме крови в норме отношение концентраций компонентов в системе сопряженного основания НСО3- и угольной кислоты Н2СО3 составляет примерно 20:1. Вследствие того, что концентрация NaHCO3 в крови значительно превышает концен-трацию Н2СО3, буферная емкость этой системы по кислоте (40 ммоль/л плазмы крови) значительно выше, чем по щелочи (1-2 ммоль/л плазмы крови).
В норме парциальное давление СО2 в крови составляет 5,3 кПа (40 мм. рт. ст.) и содержание СО2 в плазме не достигает максималь-ной величины, определяемой растворимостью газа. Поэтому избыток СО2 в атмосфере приводит к дополнительному растворению СО2 в крови, что в соответствии с уравнением (11) может сопровождаться снижением рН крови и вызывать газовую форму ацидоза:

Между СО2 в альвеолах и гидрокарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается равновесие:

При поступлении в кровь, протекающую через сосуды тканей, кислот - доноров Н+ - равновесие «3» в соответствии с принципом Ле Шателье смещается в сторону образования молекул Н2СО3. При этом концентрация Н2СО3 повышается, а концентрация ионов НСО3- соответственно понижается. В свою очередь, повышение концентра-ции Н2СО3 приводит к смещению равновесия «2» в сторону образования СО2 при разложении Н2СО3, т.е. к увеличению концен-трации растворенного в плазме СО2. В результате равновесие «1» смещается в сторону образования газообразного СО2, что приводит к повышению давления СО2 в легких и выведению последнего за счет изменения объема легочной вентиляции.
При поступлении в кровь оснований - акцепторов Н+ - сдвиг рав-новесий происходит в обратной последовательности: равновесие «3» смещается в сторону усиления диссоциации Н2СО3, т.е. уменьшения ее концентрации, что в свою очередь смещает равновесие «2», а затем и равновесие «1» вправо и сопровождается растворением в плазме крови дополнительного количества СО2(газ), содержащегося в легких.
В результате рассмотренных процессов гидрокарбонатная систе-ма крови быстро приходит в равновесие с СО2 в альвеолах и эффекти-вно обеспечивает поддержание постоянства рН плазмы крови.
Гидрокарбонатная буферная система крови способна компенси-ровать и не только газовую, но и другие формы ацидоза, возникаю-щие в процессах жизнедеятельности организма. Так, избыток молоч-ной кислоты HLac, образующийся в результате интенсивной физичес-кой нагрузки, также нейтрализуется ионом НСО3-:
HCO3- + HLac ⇄ Lac- + H2CO3 ⇄ H2O + CO2(p-p) ⇄ СО2(газ)
Гидрокарбонатная буферная система, обеспечивая около 55% всей буферной емкости крови, является основной буферной системой плазмы крови и содержится также в эритроцитах, интерстициальной жидкости, почечной ткани.
2. Фосфатная буферная система.
В поддержании постоянства рН плазмы принимает участие и фосфатная буферная система, состоящая из слабой кислоты Н2РО4- и сопряженного основания НРО42-. Фосфатная буферная система спо-собна поддерживать постоянство рН в интервале 6,2-8,2 и обеспечи-вает значительную долю буферной емкости крови.
Для фосфатной буферной системы уравнение Гендерсона-Гассельбаха выглядит так:
 .
.
Подставив физиологическое значение  и значение рН крови в норме, равное 7,4, получим:
и значение рН крови в норме, равное 7,4, получим:
 .
.
Отсюда:

Таким образом, соотношение концентраций Na2HPO4 и NaH2PO4 в фосфатной буферной системе крови приблизительно равно 4, поэтому фосфатная буферная система имеет более высокую емкость по кислоте, чем по щелочи и более эффективно нейтрализует кислые метаболиты плазмы крови, например молочную кислоту и продукты переработки мясной пищи:
НРО42- + HLac ⇄ Н2РО4- + Lac-
Образующееся в результате нейтрализации избыточное количест-во дигидрофосфат-иона H2PO4- выводится почками.
Однако, в отличие от гидрокарбонатной буферной системы, различия буферной емкости фосфатной системы по кислоте и по щелочи не столь существенны. Эти величины составляют:  = 1-2 ммоль/л,
= 1-2 ммоль/л,  = 0,5 ммоль/л.
= 0,5 ммоль/л.
Фосфатная буферная система менее мощная, чем гидрокарбонат-ная, что объясняется малым содержанием фосфатов в плазме крови. Фосфатная буферная система содержится также в тканях, особенно в почках, и внутри клеток, например, в эритроцитах.
3. Белковая буферная система.
Белковая буферная система представляет собой совокупность альбуминов и глобулинов - белков, составляющих основную часть плазмы крови (~90%).
Изоэлектрические точки этих белков лежат в интервале значений рН = 4,9-6,3, т. е., в слабокислой среде. Поэтому в физиологических условиях (при рН = 7,4) белки находятся преимущественно в формах «белок-основание» и соль «белка-основания».
Соответствующее кислотно-основное равновесие:

смещено в сторону преобладания формы «белок-основание».
Буферная емкость, определяемая белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протонакцепторных групп. Эта система может нейтрали-зовать как кислые, так и основные продукты. Однако вследствие преобладания формы «белок-основание», ее буферная емкость значи-тельно выше по кислоте и составляет: для альбуминов  = 10 ммоль/л, а для глобулинов
= 10 ммоль/л, а для глобулинов  = 3 ммоль/л.
= 3 ммоль/л.
4. Аминокислотная буферная система.
Буферная емкость свободных аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. Это связано с тем, что почти все аминокислоты имеют значения  , заметно отличающиеся от 7,4. Поэтому при физиологическом значении рН = 7,4 их мощность мала. Практически только одна аминокислота - гистидин (
, заметно отличающиеся от 7,4. Поэтому при физиологическом значении рН = 7,4 их мощность мала. Практически только одна аминокислота - гистидин (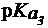 = 6,0) - обладает значительным буферным действием при значениях рН, близких к рН плазмы крови.
= 6,0) - обладает значительным буферным действием при значениях рН, близких к рН плазмы крови.
Таким образом, мощность буферных систем плазмы крови уменьшается в ряду:

гидрокарбонатная > белковая > фосфатная > аминокислотная
Эритроциты
Во внутренней среде эритроцитов норме соответствует рН = 7,25. Здесь также действуют гидрокарбонатная и фосфатная буферные системы. Однако их мощность отличается от таковой в плазме крови. Кроме того, в эритроцитах большую роль играет белковая система гемоглобин-оксигемоглобин, на долю которой приходится около 75% всей буферной емкости крови.
Гемоглобин является слабой кислотой ( = 8,2) и диссоци-ирует по уравнению:
= 8,2) и диссоци-ирует по уравнению:
HHb ⇄ H+ + Hb-
При физиологическом значении рН = 7,25 этот описывается уравнением Гендерсона-Гассельбаха:
 ,
,
из которого видно, что:
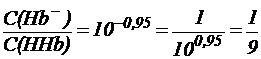 .
.
Таким образом, при рН = 7,25 кислота HHb диссоциирована только на 10% и концентрация солевой формы гемоглобина (Hb-) значительно меньше, чем концентрация кислоты (HHb).
Система HHb/Hb- может активно нейтрализовать кислые и основные продукты метаболизма, однако обладает более высокой емкостью по щелочи, чем по кислоте.
В легких гемоглобин реагирует с кислородом. При этом образуется оксигемоглобин HHbО2:
HHb + O2 ⇄ HHbО2,
который переносится артериальной кровью в капиллярные сосуды, откуда кислород попадает в ткани.
Оксигемоглобин - слабая кислота ( = 6,95), но существенно более сильная, чем гемоглобин (
= 6,95), но существенно более сильная, чем гемоглобин ( = 8,2). При физиологическом значении рН = 7,25 кислотно-основному равновесию:
= 8,2). При физиологическом значении рН = 7,25 кислотно-основному равновесию:
HHbО2 ⇄ H+ + HbО2-
соответствует уравнение Гендерсона-Гассельбаха:
 .
.
Отсюда можно заключить, что С(HbО2-)/С(HHbО2) = 2:1 и доля продиссоциировавших молекул HHbО2 составляет примерно 65%.
При добавлении кислот нейтрализовать ионы H+ в первую очередь будут анионы гемоглобина Hb-:
Hb- + H+ ⇄ HHb,
так как они имеют большее сродство к протону, чем ионы HbO2-.
При действии оснований в первую очередь будет реагировать более сильная кислота оксигемоглобин HHbO2:
HHbO2 + OH- ⇄ HbO2- + H2O,
однако и кислота гемоглобин также будет участвовать в нейтрализации поступающих в кровь ионов OH-:
HHb + OH- ⇄ Hb- + H2O.
Система гемоглобин-оксигемоглобин играет важную роль как в процессе дыхания (транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболического СО2), так и в поддержании постоянства рН внутри эритроцитов, а в результате и в крови в целом.
В организме человека все буферные системы взаимосвязаны. Так, в эритроцитах гемоглобин-оксигемоглобиновая буферная система тесно связана с гидрокарбонатной буферной системой. Поскольку внутри эритроцитов рН равен 7,25, то соотношение концентраций соли (НСО3-) и кислоты Н2СО3 здесь несколько меньше, чем в плазме крови. Действительно, из уравнения Гендерсона-Гассельбаха следует, что в эритроцитах C(НСО3-)/С(Н2СО3) = 14:1. Тем не менее, несмотря на то, что буферная емкость этой системы по кислоте внутри эритроцитов несколько меньше, чем в плазме, она эффективно поддерживает постоянство рН.
Фосфатная буферная система играет в клетках крови гораздо более важную роль, чем в плазме крови. Прежде всего это связано с тем, что в эритроцитах содержится большое количество неорганичес-ких фосфатов, главным образом, KH2PO4 и K2HPO4. Кроме того, большую роль в поддержании постоянства рН имеют эфиры фосфорных кислот - главным образом, фосфолипиды, составляющие основу мембран эритроцитов.
Фосфолипиды являются относительно слабыми кислотами. Значения  фосфатных групп находятся в пределах от 6,8 до 7,2. Следовательно, при физиологическом значении рН = 7,25 фосфоли-пиды мембран эритроцитов находятся как в виде неионизированных, так и в виде ионизированных форм, т.е. в виде слабой кислоты и ее соли. При этом соотношение концентраций соли и кислоты приблизительно составляет (1,5-4):1. Таким образом, сама мембрана эритроцитов обладает буферным действием и поддерживает посто-янство рН внутренней среды эритроцитов.
фосфатных групп находятся в пределах от 6,8 до 7,2. Следовательно, при физиологическом значении рН = 7,25 фосфоли-пиды мембран эритроцитов находятся как в виде неионизированных, так и в виде ионизированных форм, т.е. в виде слабой кислоты и ее соли. При этом соотношение концентраций соли и кислоты приблизительно составляет (1,5-4):1. Таким образом, сама мембрана эритроцитов обладает буферным действием и поддерживает посто-янство рН внутренней среды эритроцитов.
В случаях, когда буферная и выделительная защита организма исчерпывает свои возможности и развивается тяжелая форма ацидоза (алкалоза), прибегают к медикаментозному подавлению этих наруше-ний. Так, при газовой форме ацидоза внутривенно вводят препараты основного характера, представляющие собой соли слабых кислот: 4%-й раствор NaHCO3, раствор натриевой соли лимонной кислоты - цитрат натрия (Na3Cit) и др., которые нейтрализуют избыточную кислотность, связывая ионы H+ в слабые кислоты:
H+ + HCO3-  H2CO3
H2CO3  H2O + CO2
H2O + CO2
Ликвидацию метаболической формы ацидоза также проводят пу-тем введения солей слабых кислот и других препаратов, обладающих свойством проходить через фосфолипидные мембраны.
При алкалозе вводят растворы слабых кислот, например, 4%-й раствор аскорбиновой кислоты.
Однако перечисленные методы медикаментозного вмешательства не имеют, строго говоря, лечебного эффекта: они позволяют лишь «выиграть время» для более детального установления причин возник-новения отклонений и назначения курса лечения или профилактики.
Буферные системы слюны
Поддержание постоянства pH слюны в пределах нормы (6,35-6,85) обеспечивается, главным образом, тремя буферными системами: гидрокарбонатной, фосфатной и белковой. Главную роль в нейтрализации кислотно-основных метаболитов играет гидрокарбо-натная буферная система, которая обеспечивает 80% буферной емкости слюны. Второй по значимости является фосфатная система, третьей - белковая. Буферная емкость слюны может варьировать и зависит от характера питания, состояния желудочно-кишечного тракта и других факторов.