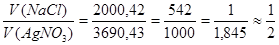Адсорбция – процесс самопроизвольного поглощения вещества (адсорбтива) поверхностью адсорбента. Уравнение Гиббса устанавливает взаимосвязь величины адсорбции (Г, кмоль/кг или кмоль/м 2) с изменением поверхностного натяжения (Джм2 от концентрации раствора (С, кмольл). 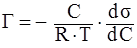 ,
,
где С – концентрация раствора, кмоль/л;
R – универсальная газовая постоянная;
T – температура;
ddС – производная, являющаяся мерой поверхностной активности; может быть определена графически по зависимости поверхностного натяжения от концентрации (при ).
Физические процессы молекулярной адсорбции на твердой поверхности описываются уравнениями Ленгмюра и Фрейндлиха.
Уравнение Ленгмюра:
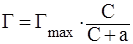 ,
,
где Г – величина адсорбции, кмоль/кг или кмоль/м2;
Гmax – величина предельной адсорбции, кмоль/кг (кмоль/м2);
С – концентрация раствора, кмоль/л;
а – константа равновесия адсорбции.
Это уравнение хорошо описывает адсорбцию для малых и больших концентраций растворов (или давлений газа).
Эмпирическое уравнение Фрейндлиха:
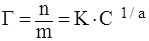 ,
,
где Г – величина адсорбции, кмоль/кг (кмоль/м2);
n – количество вещества-адсорбтива, кмоль;
m – масса адсорбента, кг;
К – константа (при С = 1 моль/л К = Г);
1/а – константа (адсорбционный показатель); зависит от природы адсорбента и температуры. 1/а = 0,1–1.
Уравнение (2.11) хорошо описывает адсорбцию для интервала средних концентраций растворов (или давлений газа).
Адсорбция на жидкой поверхности может приводить как к уменьшению поверхностного натяжения (например, при адсорбции малорастворимых, дифильных поверхностно-активных веществ), так и к его увеличению (в частности, при адсорбции поверхностно-инактивных веществ, т. е. хорошо растворимых в воде неорганических электролитов) или не изменять его (растворы сахаров в воде). В последнем случае вещество распределяется равномерно между поверхностным слоем и объемом раствора.
Адсорбция кислорода на поверхности мелких порошков и аэрозолей в ряде случаев может приводить к резкому ускорению процесса окисления дисперсной фазы, что может стать причиной самовозгорания и даже взрыва, например, мелкодисперсной муки, мучной, сахарной пыли и т. п. Ионная адсорбция может быть обратимой или необратимой. Обратимая адсорбция является основой ионообменной хроматографии.
Газовая хроматография может быть разделена на газо-адсорбционную (газо-твердую) и газо-жидкостную. В первом случае неподвижной фазой служит твердое вещество — адсорбент, во втором — жидкость, распределенная тонким слоем по поверхности какого-либо твердого носителя (зерненого материала, стенок колонки).
82. В каком объемном соотношении следует смешать 0,029 %-ный раствор NaCl и 0,001 н раствор AgNO3, чтобы получить незаряженные частицы золя AgCl? Плотность раствора NaCl равна 1 г/мл.
Решение. Запишем уравнение реакции:
NaCl + AgNO3 = AgCl + NaNO3
0,029 0,001 н.
Запишем формулу мицеллы: [m (AgСl) n Cl– · (n-1) Ag+]1– x Ag+
Для того, чтобы ее получить, следует взять в избытке раствор NaCl.
Исходя из формулы %-ной концентрации вещества можно записать, что:
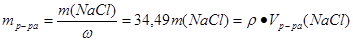
Для того, чтобы определить массу растворенного нитрата серебра, воспользуемся формулой:
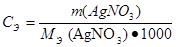
Откуда масса вещества AgNO3 равна:
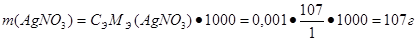
По уравнению масса хлорида натрия:
х_-------------------------107 г.
58 г/моль------------------107г/моль
х=58 г
Объем раствора хлорида натрия:
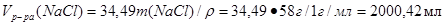
Объем раствора нитрата серебра
2000, 42 мл----------------------------х мл
58 г/моль 107 г/моль
х = 2000, 42*107 /58 = 3690,43 мл
Соотношение объемов веществ: