Лабораторная работа № 8
Коррозия металлов
Опыт 1. Контактная коppозия металлов (макрогальванокоppозия)
Впробирку налейте 2 н pаствоp cepной кислоты H2SO4. Опустите гранулу чистого цинка (без примесей). Наблюдается ли вытеснение водорода из серной кислоты? Запишите наблюдения. Составьте уравнение реакции.
Затем опустите медную проволоку, не доводя ее до соприкосновения с цинком. Выделяется ли водород на меди? Почему?
Погрузите медную проволоку глубже так, чтобы она контактировала с цинком. Как изменяется интенсивность выделения водорода, и на каком из металлов он выделяется? Отодвиньте медную проволоку от цинка и убедитесь, что интенсивность выделения водорода снова изменяется.
Объясните выделение водорода на меди при контакте металлов Zn-Cu. Для этого составьте схему образующейся коррозионной макрогальванопары в растворе серной кислоты. Укажите, какой металл будет являться анодом, а какой – катодом. Почему? Покажите направление перехода электронов в паре цинк-медь; укажите знаки анода и катода. Напишите уравнения электродных процессов. Какой металл растворяется? При каких условиях скорость его растворения увеличивается? Составьте уравнения реакции образования продуктов коррозии.
Опыт 2. Коррозия в результате различного доступа кислорода
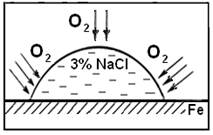 На свежеочищенную поверхность стальной пластины нанесите каплю специального реактива, состоящего из 3 % раствора NaCl, 0,5 н раствора K3[Fe(CN)6] и фенолфталеина.
На свежеочищенную поверхность стальной пластины нанесите каплю специального реактива, состоящего из 3 % раствора NaCl, 0,5 н раствора K3[Fe(CN)6] и фенолфталеина.
Наблюдайте появление синего окрашивания в центре капли и розового по краям капли. Сделайте в отчете схему -рисунок опыта для наблюдения коррозии железа (стали) под каплей 3 % раствора NaCl. Покажите на рисунке участки капли с различной окраской.
Для рассмотрения механизма коррозии составьте схему коррозионной пары, образующейся в результате различной аэрации слоев раствора NaCl по краям и в центре капли. Укажите на рисунке, какой участок будет являться анодом, а какой – катодом; их знаки. Покажите направление перехода электронов.
Напишите уравнения электродных процессов и реакций образования всех продуктов коррозии железа.
Следует обратить внимание на то, что K3[Fe(CN)6] добавлен в 3 % раствор NaCl как чувствительный реактив на ионы Fe2+, В том случае, если действительно происходит коррозия железа (стали), то образуются ионы Fe2+. Эти ионы образуют Fe3[Fe(CN)6], которое дает синее окрашивание (реакция 2):
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3- (1)
 3Fe2+ + 2[Fe(CN)6]3− = Fe3[Fe(CN)6]2 (2)
3Fe2+ + 2[Fe(CN)6]3− = Fe3[Fe(CN)6]2 (2)
 синяя окраска
синяя окраска
Объясните, чем вызвано появление различной окраски в центре капли и по краям капли. Покажите на рисунке, где происходит коррозия железа (стали) под каплей. Какой
характер имеет коррозионное разрушение железа?
Сделайте вывод:
- о влиянии различного доступа кислорода (воздуха) на коррозию металлов в условиях капельной конденсации, а также при наличии на поверхности металла влажной пленки электролита различной толщины.
- Как называется коррозионная пара, которая образуется при различном доступе кислорода? (Ответ – Пара дифференциальной аэрации)
Рекомендации:
К опыту 1. В 4-ой графе следует записать:
Схема коррозионной пары:
(–) анод Zn │ H2SO4│ Cu катод (+)

 Электродные процессы:
Электродные процессы:
анод (–): Zn0 – 2ē 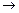 Zn2+ 1
Zn2+ 1
катод (+): 2H+ + 2ē 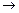 2Н0 = Н2
2Н0 = Н2 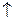 1
1
 |
Продукты коррозии: Zn0 + 2H+ = Zn2+ + Н2 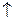
Zn0 + H2SO4 = ZnSO4 + Н2 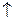
 продукты коррозии
продукты коррозии
К опыту 2. В 4-ой графе следует записать:
Схема коррозионной пары под каплей:
(–) анод Feцентр│ H2O, O2 │ Feкрай катод (+)
кислорода меньше кислорода больше
Электродные процессы:

 анод (–): Fe0 – 2ē
анод (–): Fe0 – 2ē 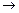 Fe2+ 2
Fe2+ 2
катод (+): О2 + 2Н2О + 4ē 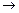 4ОН– 1
4ОН– 1
 |
Продукты коррозии:
 2Fe0 + О2 + 2Н2О = 2Fe2++4ОН– = 2Fe(ОН)2
2Fe0 + О2 + 2Н2О = 2Fe2++4ОН– = 2Fe(ОН)2 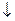
серо-зеленый осадок
 4Fe(ОН)2
4Fe(ОН)2 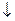 + О2 + 2Н2О = 4Fe(ОН)3
+ О2 + 2Н2О = 4Fe(ОН)3 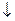
красно-коричневый осадок

 Fe(ОН)3
Fe(ОН)3 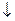
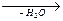 FeО(ОН)
FeО(ОН) 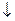 → mFexOy ∙ nH2O
→ mFexOy ∙ nH2O 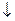
бурая ржавчина ржавчина