Ламинин – крупный гликопротеин (70 нм), состоит из 3 цепей: А,В, и В2 , соединенных дисульфидными связями (рис. 73). Ламинин содержит домены связывающие коллаген IV типа (см. ниже) и интегрин. Он является компонентом базальной мембраны, внеклеточной структуры эпителиальных тканей, соединяющей эпителиоциты с соединительной тканью (рис.74). Молекула ламинина играет роль связующего звена между другими компонентами внеклеточного матрикса, участвует в функционировании и активации клеток. Ламинин принимает участие в процессе формирования дифференцированных клеток, а также осуществлении адгезии. Эти процессы необходимы для кожи, для того, чтоб обеспечить ее правильное функционирование.
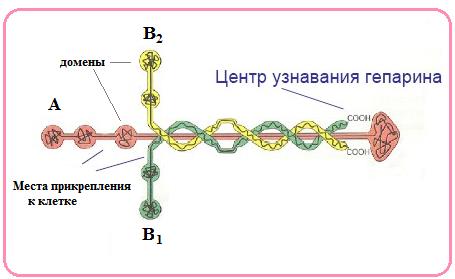
Рис. 73. Схематическое изображение молекулы ламинина (Из:
Интернет-ресурсов с сайта htth// www.my-formula.ru/wp-cor
Uhloads)
Базальная мембрана (рис.75) – тонкая листовидная структура, состоящая из фибронектина, адгезивных и неадгезивных гликопроте-
инов, ламинина, коллагена IV типа и протеогликанов, гликопротеинов.

Рис.74. Схема расположения базальной мембраны (Из:Северин,2007)

Рис.75. Схема строения базальной мембраны (Из: Интернет-
ресурсов с сайта htth// www.my-formula.ru/wp-cor uhloads)
Эти белки составляют основную часть базальной мембраны.
Базальная мембрана сложно организована и, кроме каркасной функции для клеток эпидермиса и скрепления эпидермиса и дермы, оказывает влияние на регенерацию кожи, выполняет функцию прикрепления, дифференцировки клеток и восстановления эпителиальных тканей. Одновременно с поддерживающей функции, она выполняет функцию молекулярного сита, обеспечивающего избирательную фильтрацию из крови небольших молекул.
Ламинин обеспечивает прикрепление базальной мембраны к клеткам, сшивая коллаген с интегрином клеточной поверхности, т.к. сам коллаген связываться с интегрином напрямую не может.
Энтактин – гликопротеин, который связывает ламинин и коллаген IV типа (рис.75).
Эти три белка: фибронектин, ламинин и энтактин играют важную роль в межклеточных взаимодействиях и взаимодействиях клетка – внеклеточный матрикс. Они взаимодействуют с рецепторами плазмо- леммы (например, интегрином), которые через внутриклеточные белки: талин, винкулин и α-актин передают информацию на актиновые филаменты цитоскелета (рис.76). Поэтому любые изменения в внеклеточном матриксе ведут к изменению функций клеток. Существует и обратный путь передачи информации.
Волокна выполняют опорную, формообразующую функции, функцию придания клеткам эластичности и регуляции функций клеток. Различают коллагеновые, эластические и ретикулярные волокна.


 nature.com JPG 755×329, 159 КБ
nature.com JPG 755×329, 159 КБ
Рис.76. Схема взаимодействия фибронектина и интегрина (Из:Фаллер,2004)
Коллагеновые волокна состоят из фибриллярного белка. Молекула коллагена состоит из трех полипептидных α-цепей, скрученных друг с другом в правостороннюю суперспираль. Каждый третий аминокислотный остаток – глицин, обеспечивающий способность цепям скручиваться в канатовидную структуру (рис.77). Имеется 25 видов α-спиралей коллагена, образующих 19 типов коллагена (табл8-6), из них наиболее распространенные 5 типов (табл. Фал. Стр. 190), которые способны формировать филаменты и фибриллы. Остальные коллагены является аморфными.

Рис.77. Организация белка коллагена: фибрилла диаметром 67 нм; фибрилла диаметром 300нм; тройная спираль диаметром 1.4 нм; α-спираль; аминокислотная последовательность первичной структуры полипептида; (Из: Фаллер, Шилдс,2004)
Полипептиды коллагена синтезируются в гранулярной ЭПС и образуют α-спирали, которые там же подвергаются гликозилированию гидроксилизина при участии витамина С. 3 цепи α-спиралей скручиваются с образованием суперспирали – протоколлагена, в котором каждая цепь сдвинута относительно к другой на 1-4 длины, что обеспечивает поперечную исчерченность. Далее протоколлаген поступает в аппарат Гольджи, где также модифицируется и доставляется во внеклеточный матрикс. Во внеклеточном матриксе протоколлаген в результате отщепления концевых участков превращается в тропо- коллаген (рис.78). Последний полимеризуется: молекулы тропоколлагена соединяется конец в конец и сторона к стороне, образуя протофибриллу; 5-6 протофибрилл образуют микрофибриллы, которые склеиваются при участии глюкозамингликанов в фибриллы (рис.79). Несколько фибрилл соединяются, образуя коллагеновые волокно (например, сухожилия).


Рис.78. Строение молекулы тропоколлагена (Из:Северин, 2007)
Рис. 79. Строение коллагеновой фибриллы (Из:Северин, 2007)
В коже коллагеновые фибриллы приплетаются крест на крест, что обеспечивают устойчивость тканей к растяжению.
Коллаген выполняет следующие функции: 1- обеспечение прочности тканей; 2-опорная; 3-информационно–регуляторная, 4 - участие в морфогенезе, 5 – участие в дифференцировке и регенерации клеток, 6 - регуляция миграции клеток, адгезии, образования тромбов, обеспечение архитектоники соединительной ткани.
При многих генетических заболеваниях нарушается нормальный синтез коллагена. Генетические дефекты приводят к неполной сборке молекулы коллагена, нестабильности суперспирали, нарушению поперечных связей коллагена и др. При нарушении обмена меди снижается уровень медьсодержащего фермента лизиноксидазы, обеспечивающего образование поперечных сшивок молекул коллагена и развивается болезнь Менкеса. Мутация гена, кодирующего α2-цепь коллагена IV вызывает дефект базальной мембраны клеток почечных клубочков и развитие синдрома Альпорта. Некоторые другие заболевания, связанные с нарушением синтеза коллагена указаны в таблице. фал. Стр 193
Эластические волокна – состоят из аморфного белка эластина и белка, образующего микрофибриллы – фибриллина. Эластин содержит много глицина и две уникальные аминокислоты десмозин и изодесмозин. Десмозин образован из боковых цепей четырех остатков лизина. Молекулы эластина имеют вид глобулы, которые во внеклеточном матриксе соединяется в цепочки с образованием эластиновых протофибрилл. Соединение аморфных протофибрилл эластина и фибриллярного фибриллина образует эластиновое волокно, которое способно после растяжения возвращаться в исходное состояние, обеспечивая ткани эластичность (рис.80).
Ретикулярные волокна по химической основе относятся к коллагеновым волокнам, т.к. состоят из коллагена III типа. Основная функция ретикулярных волокон – опорная.
Внеклеточный матрикс выполняет следующие функции:
1 - опорная;
2 - обеспечение обменных процессов и поступление в клетку ве -ществ;
3 - регуляторная;
4 - морфогенетическая: внеклеточный матрикс принимает участие в формировании тканевой архитектоники, гисто-, и органогенезе, канцеро- генезе и метастазировании опухолевых клеток; заживлении ран;
5 - транспортная: обеспечивает поступление к клетку необходимых регуляторных и питательных веществ.
Клеточная адгезия
В заимодействие клеток друг с другом и клеток с внеклеточным матриксомобеспечивает клеточная адгезия.
Клеточная адгезия – (от лат. adhaesio – прилипание, слипание) - это процесс распознавания и взаимодействия между специфическими гликопротеинами двух соприкасающихся плазматических мембран клеток или мембран клеток и внеклеточного матрикса. Если гликопротеины узнают друг друга, то образуются связи и происходит адгезия, а затем формирование прочных межклеточных контактов или контактов клетки и межклеточного матрикса. Адгезия является важным звеном в процессах тканеобразования, межклеточной сигнализации, межклеточных взаимо- действий. Это абсолютно необходимый процесс в эмбриогенезе, иммунном ответе, росте, регенерации. Адгезия участвует в регуляции внутриклеточного и тканевого гомеостаза. Молекулы обеспечивающие клеточную адгезию – это гетерогенная группа белков, которые постоянно присутствуют на мембране клеток (эндотелиоцитов, лейкоцитов, тромбоцитов).
Адгезивные молекулы делятся на три большие группы: суперсемейство иммуноглобулинов (иммуноглобулины Ig и Ig-подобные белки ); интегрины - трансмембранные белки, расположенные на поверхности клеток и способные связываться с другими белками и передавать внеклеточные сигналы; селектины - комплементарные белки, 3 типов: селектин Е,располагающийся на эндотелии, селектин Р –тромбоцитах, селектин L – лейкоцитах; кадгерины.
Гликопротеины, обеспечивающие адгезию на начальном этапе адгезивного взаимодействия, играют роль рецепторов, узнающих определенные вещества на поверхности взаимодействующих мембран. Они является белками, обеспечивающими непосредственное взаимо- действие клеток. Кроме этого, они обеспечивают межклеточные адгезионные контакты, необходимые для поддержания целостности ткани.
Кадгерины – это семейство трансмембранных белков с массой 120-140кДж. Они используют для адгезии ионы кальция, то есть, являются Са+-зависимыми рецепторами адгезии. Они также важны для распознавания и сортировки клеток в процессе развития и находятся на мембранах многих клеток. Известно более 10 таких белков (табл.). Каждый белок разделен на 5 эктодоменов (ЕС1-ЕС5), по 100 аминокислот в каждом (рис.81). Все белки гомологичны на 52-73% и содержат по 4 остатка цистеина. Структура их аналогична белкам десмосом (см.ниже) – десмоглеинам и десмоколлинам.
Межклеточная адгезия – это кальций-зависимый процесс. Кадгерины обеспечивают адгезию только в присутствии Са2+. При удалении внеклеточного Са2+ происходит распад тканей на отдельные клетки. При связывании кадгеринов мембран двух соседних клеток адгезия обеспечивается гомофильной связью, т.е., молекула кадгерина одной мембраны связывается с точно такой же молекулой кадгерина другой мембраны по типу кадгериновой «молнии» (рис.). Молекулы кадгерина, находящиеся на поверхности соприкасающихся мембран образуют димер. 1-й внеклеточный домен (ЕС1) кадгерина мембраны одной клетки взаимодействует с двумя соседними ЕС1 доменами другой мембраны, ориентированными в противоположном направлении. Образуется адгезионный контакт - один из видов плотных межклеточных контактов (подробнее см.ниже. «Межклеточные контакты»).
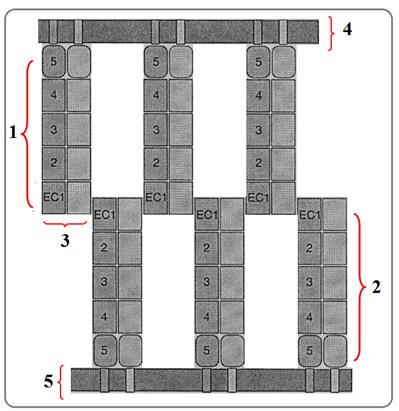
Рис.81. Клеточная ад-гезия, обусловленная бел-ками кадгеринами:
1 – домены кадгерина од-ной мембраны: ЕС1-ЕС5; 2 - домены кадгерина дру-гой мембраны: ЕС1-ЕС5;