Алюминий. Соединенияалюминия.
I. Алюминий –простое вещество.
1. Порошкообразный алюминий легко взаимодействует с неметаллами
4Al + 3O2 = 2Al2O3 2Al + N2 = 2AlN 4Al + 3C 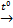 Al4C3
Al4C3
2. Очищенный от оксидной пленки алюминий способен взаимодействовать с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
3. Алюминий восстанавливает металлы из их оксидов (алюмотермия)
2Al +Cr2O3 = Al2O3 + 2Cr
Al + 3Fe3O4 = 4Al2O3 + 9Fe
4. Как активный металл алюминий реагирует с растворами кислот с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб.)= Al2(SO4)3 + 3H2
Концентрированные серная и азотная кислоты на холоду пассивируют алюминий, однако, при сильном нагревании они растворяют алюминий.
2Al + 6H2SO4(конц.)  Al2(SO4)3 + 3SO2 + 6H2O
Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(конц..)  Al(NO3)3 + 3NO2 + 3H2O
Al(NO3)3 + 3NO2 + 3H2O
10Al + 36HNO3(разб.) = 10Al(NO3)3 + 3N2 + 48H2O
8Al + 30HNO3(разб.)= 8Al(NO3)3 + 3N2O + 15H2O
8Al + 30HNO3(оч. разб.)= 8Al(NO3)3 + 3NH4NO3 + 9H2O
5. При нагревании с концентрированными растворами щелочей алюминий образует комплексные соли.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2Al + 6NaOH  2Na3AlO3 + 3H2 (сплавление)
2Na3AlO3 + 3H2 (сплавление)
6. Взаимодействие со сложными веществами
2Al + 3Na2O2  2NaAlO2 + 2Na2O
2NaAlO2 + 2Na2O
8Al + 3KNO3 + 5KOH + 18H2O = 8K[Al(OH)4] + 3NH3
10Al + 6KMnO4 + 24H2SO4 = 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O
2Al + NaNO2 + NaOH + 5H2O = 2Na[Al(OH)4] + NH3
Al + 3KMnO4 + 4KOH = 3K2MnO4 + K[Al(OH)4]
4Al + K2Cr2O7  2Cr + 2KAlO2 + Al2O3
2Cr + 2KAlO2 + Al2O3
II. Cоединения алюминия.
1) Оксид алюминия – типичный представитель амфотерных оксидов. Он взаимодействует и с кислотами, и с щелочами, с кислотными и основными оксидами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
При сплавлении оксида алюминия с щелочами образуется метаалюминат.
Al2O3 + 2NaOH 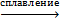 2NaAlO2 + H2O
2NaAlO2 + H2O
Al2O3 + 2KOH 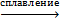 2KAlO2 + H2O
2KAlO2 + H2O
Al2O3 + 3N2O5 = 2Al(NO3)3
Al2O3 +K2O 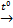 2KAlO2
2KAlO2
В соответствующие соли оксид алюминия можно перевести с помощью солей, кислотные или основные свойства которых выражены в меньшей степени:
Al2O3 + 6KHSO4 = Al2(SO4)3 + 3K2SO4 + 3H2O
Al2O3 + Na2CO3 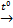 2NaAlO2 + CO2
2NaAlO2 + CO2
Al2O3 + 3CaH2 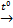 3CaO + 2Al + 3H2
3CaO + 2Al + 3H2
2Al2O3  4Al+ 3O2 (получение алюминия)
4Al+ 3O2 (получение алюминия)
на катоде на аноде
2) Гидроксид алюминия проявляет амфотерные свойства:
ПолучениеAl2(SO4)3 + 6(NH3 ∙ H2O) = 2Al(OH)3↓ + 3(NH4)2SO4 (
AlCl3 + 3(NH3 ∙ H2O) = Al(OH)3 + 3NH4Cl
Al(OH)3 + NaOH = Na[Al(OH)4]Al(OH)3 + NaOH 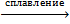 NaAlO2 + 2H2O
NaAlO2 + 2H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Гидроксидалюминиятермическинеустойчив:2Al(OH)3 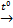 Al2O3 + 3H2O
Al2O3 + 3H2O
Соли.
Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3
Na[Al(OH)4] + SO2 = Al(OH)3↓ + NaHSO3
Na[Al(OH)4] + 4HCl(избыток) = NaCl + AlCl3 + 4H2O
Na[Al(OH)4] + НCl(недостаток) = Al(OH)3↓ + NaCl + H2O
Na[Al(OH)4] + HNO3(недостаток) = Al(OH)3↓ + NaNO3 + H2O
2Na[Al(OH)4] + Cl2 = 2Al(OH)3↓ + NaCl + NaClO
AlCl3 + 3Na[Al(OH)4] = 4Al(OH)3↓ + 3NaCl
Na[Al(OH)4] 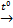 NaAlO2 + 2H2O↑
NaAlO2 + 2H2O↑
2AlCl3 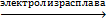 2Al + 3Cl2
2Al + 3Cl2
на катоде на аноде
4Al(NO3)3 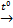 2Al2O3 + 12NO2 + 3O2
2Al2O3 + 12NO2 + 3O2
2Al2(SO4)3 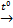 2Al2O3 + 6SO2 + 3O2
2Al2O3 + 6SO2 + 3O2
Al2(SO4)3 + 6NaHSO3 = 2Al(OH)3 + 6SO2 + 3Na2SO4
Al(NO3)3 + 4KOH(избыток) = K[Al(OH)4] + 3KNO3
Al(NO3)3 + 3(NH3 ∙ H2O) = Al(OH)3↓ + 3NH4Cl
AlCl3 + 3(NH3 ∙ H2O) = Al(OH)3 + 3NH4Cl
Al2(SO4)3 + 6(NH3 ∙ H2O) = 2Al(OH)3↓ + 3(NH4)2SO4
Al2(SO4)3 + 6NaOH (недостаток) = 2Al(OH)3↓ + 3Na2SO4
Al2(SO4)3 + 8NaOH(избыток) = 2Na[Al(OH)4] + 3Na2SO4
AlCl3 + 3NaOH(недостаток) = Al(OH)3↓ + 3NaCl
Al(NO3)3 + 4KOH 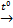 KAlO2 + 3KNO3 + 2H2O
KAlO2 + 3KNO3 + 2H2O
KAlO2 + H2O = K[Al(OH)4]
NaAlO2 + 2H2O = Na[Al(OH)4]
Гидролиз солей алюминия и по катиону слабого основания, и по аниону слабой кислоты:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + CO2↑ + 6NaBr
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
2) Бинарныесоединения.
Al2 S3+ 8HNO3 = Al2(SO4)3 + 8NO2 + 4H2O
Al2 S3+ 30HNO3(конц.гор.)= 2Al(NO3)3 + 24NO2 + 3H2SO4 + 12H2O
Al2S3 +6H2O = 2Al(OH)3↓ + 3H2S↑
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
AlN + 3HCl = AlCl3 + NH3
AlN + 3H2O = Al(OH)3↓ + NH3
Тестовое задание по теме «Алюминий и его соединения»
1. Алюминий не взаимодействует с водой при комнатной температуре ввиду того, что:
а) стоит в ряду напряжений правее водорода;
б) обладает амфотерными свойствами;
в) его поверхность покрывается пассивирующей плёнкой оксида и гидроксида;
г) относится к благородным металлам.
2. Алюминий в промышленности получают:
а) электролизом водного раствора сульфата алюминия;
б) при восстановлении оксида алюминия углём;
в) при восстановлении оксида алюминия водородом;
г) электролизом расплава Na3[AlF6] и Al2O3.
3. При взаимодействии алюминия с разбавленной азотной кислотой основными продуктами реакции являются вещества:
а) Al(NO3)3 + H2; в) Al(NO3)3 + NO2;
б) Al(NO3)3 + H2O; г) Al(NO3)3 + NH4NO3 + H2O.
4. Гидроксид алюминия при сплавлении с гидроксидом калия образует:
а) K3[Al(OH)6]; в) K[Al(OH)4];
б) KAlO2; г) K3AlO3.
5. При взаимодействии алюминия с водным раствором гидроксида калия образуются вещества:
а) K3[Al(OH)6] + H2; в) K3[Al(OH)6] + H2O;
б) KAlO2 + H2O; г) KAlO2 + H2.
6. Оксид алюминия нельзя получить при:
а) окислении металла кислородом;
б) термическом разложении K3[Al(OH)6];
в) термическом разложении Al(NO3)3;
г) термическом разложении Al(OH)3.
7. Необратимый гидролиз происходит при взаимодействии с водой:
а) AlCL3; б) AlBr3; в) AlI3; г) Al2S3.
8. При взаимодействии карбида алюминия и воды образуются:
а) Al(OH)3 + CH4; б) Al2O3 + CH4;
в) Al(OH)3 + H2; г) Al(OH)3 + C2H2.
9. С какими веществами реагирует алюминий при обычных условиях:
а) водный раствор гидроксида калия;
б) концентрированная азотная кислота;
в) концентрированная серная кислота;
г) разбавленная серная кислота.
10. Какую роль играет алюминий в алюмотермических процессах:
а) восстановителя; б) окислителя; в) катализатора;
г) вещества, создающего защитную оксидную плёнку.
11. В реакциях с какими веществами оксид алюминия проявляет свойства кислотного оксида:
а) водой; б) кислотами; в) щелочами; г) основными оксидами.
12. Какие вещества образуются при взаимодействии в обычных условиях амальгамированного алюминия с водой:
а) оксид алюминия; б) гидроксид алюминия; в) водород; г) гидрид алюминия.
13. В реакциях с какими веществами гидроксид алюминия проявляет свойства основания:
а) гидроксид натрия; б) соляная кислота; в) серная кислота; г) гидроксид калия.
14. К 25г 8%-ного раствора хлорида алюминия прилили 25г 8%-ного раствора гидроксида натрия. Образовавшийся осадок отфильтровали и прокалили. Определите его массу и состав.
15. При растворении 1,11г железных и алюминиевых опилок в 18,3%-ной соляной кислоте(плотность 1,09г мл) выделилось 0,672л водорода(при н.у.). Найдите массовые доли металлов в смеси и определите объём соляной кислоты, израсходованной на растворение металлов.
16. При обработке 31,5г смеси алюминия с оксидом алюминия раствором гидроксида натрия с массовой долей щелочи 20% (плотность 1,2г мл) выделилось 20,16л газа(н.у.). Определить состав смеси и объём раствора гидроксида натрия, израсходованного на растворение смеси.
17. 13,8г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2л газа. При действии на такую же массу смеси избытка соляной кислоты выделяется 8,96л газа. Определите массы компонентов смеси.
18. Элементы А и В, расположённые в одном периоде периодической системы, образуют между собой соединение, содержащее 79,77% элемента В. При гидролизе этого соединения выделяется газ, обладающий кислотными свойствами и содержащий 2,74% водорода и 97,26% элемента В. Выведите молекулярную формулу соединения и напишите уравнение реакции его гидролиза.