Физико-химические основы
Теплотехнических, теплоэнергетических
и теплотехнологических процессов
Методические указания
и контрольные задания для бакалавров
направления 13.03.01 "Теплоэнергетика и теплотехника"
заочной формы обучения
Одобрено
редакционно-издательским советом
Саратовского государственного
технического университета
Саратов – 2015
Все права на размножение и распространение в любой форме остаются за разработчиком.
Нелегальное копирование и использование данного продукта запрещено.
Составители: Агеев Михаил Александрович, Мракин Антон Николаевич
Под редакцией: М. А. Агеева
Рецензент:
410054, Саратов, ул. Политехническая, 77
Научно-техническая библиотека СГТУ
тел. 99-86-55, 99-86-56
https://lib.sstu.ru
Регистрационный
номер
© Саратовский государственный
технический университет, 2015
ВВЕДЕНИЕ
В XVII и XVIII столетиях между физикой и химией проводилась резкая граница, и все явления природы четко делились на физические и химические. Однако в XIX веке, особенно во второй его половине, постепенно становилось все более ясным, что невозможно установить определенные границы между этими науками, так как нельзя отделить физические явления от химических.
Химические реакции всегда связаны с разнообразными физическими процессами: выделением или поглощением тепла, излучением или поглощением электромагнитных колебаний, возникновением электрического тока при прохождении реакции в гальваническом элементе, протеканием химических реакций и т.д.
Физическая химия уделяет главное внимание исследованию законов протекания химических процессов во времени и законов химического равновесия. Основная общая задача физической химии – предсказание временного хода химического процесса и конечного состояния (состояния равновесия) в различных условиях на основании данных о строении и свойствах молекул веществ, составляющих изучаемую систему.
Велико и постоянно возрастает значение физико-химических исследований в развитии химической промышленности (основной органический и неорганический синтез, нефтехимия, производство пластических масс и химического волокна и др.) и многих других отраслей (металлургия, нефтяная промышленность, производство полупроводников, разработка химических источников тока и т.д.).
Такие важнейшие производственные процессы в химической технологии, как синтез и окисление аммиака, контактное получение серной кислоты, производство этанола из природного газа, крекинг нефти, получение чугуна в доменных печах, производство алюминия и многие другие, всецело основаны на результатах физико-химического исследования реакций, лежащих в основе этих процессов.
Цель преподавания дисциплины “Физико-химические основы теплотехнических, теплоэнергетических и теплотехнологических процессов” является изучение общих законов и принципов теплотехнологических процессов для последующего проектирования и эксплуатации теплотехнологических установок в основных отраслях промышленности.
Задачи изучения дисциплины состоят в понимание физико-химических основ теплотехнологических процессов и изучение вопросов равновесия и кинетики химических процессов, протекающих в теплотехнологическом оборудовании промышленных предприятий, а также методов расчета физико-химических параметров веществ и процессов и основ кинетических закономерностей протекания гомогенных и гетерогенных физико-химических процессов.
Задача №1: Вычислить тепловой эффект реакции А при Р=const при 298 К и температуре Т. Тепловые эффекты образования веществ взять из справочника [1] или таблиц 4,5 приложения.
1. Определить тепловой эффект химической реакции "А" при температуре Т.
2. Рассчитать термодинамический потенциал реакции "А" и сделать вывод о направлении процесса.
3. Определить константу равновесия реакции "А".
Таблица 1
| № варианта | Реакция А | Т, К |

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

| ||

|
Задача №2: Дана зависимость состава жидкой фазы и находящегося с ней в равновесии пара от температуры для двухкомпонентной жидкой системы А-В при постоянном давлении. Молярный состав жидкой фазы x и насыщенного пара у выражен в процентах вещества А. По приведенным данным в таблицах 2 и 3 выполнить следующие задания:
1. построить график зависимости состава пара от состава жидкой фазы при постоянном давлении;
2. построить диаграмму кипения системы А-В;
3. определить температуру кипения системы с молярной долей а % вещества А;
4. определить состав пара, находящегося в равновесии с жидкой фазой, кипящей при температуре Т1;
5. какой компонент и в каком количестве может быть выделен из системы, состоящей из b кг вещества А и с кг вещества В.
Таблица 2
| № варианта | Система | 
| Молярная доля А, % | Т, К | |
| х -жидкая фаза | у -паровая фаза | ||||
А-  В-
В- 
| 10,133 | 0,0 8,4 12,3 22,1 30,8 38,3 40,2 46,5 53,0 61,5 100,0 | 0,0 0,6 1,8 6,6 16,6 38,3 60,2 75,9 89,1 92,1 100,0 | 379,5 391,5 394,6 394,9 394,0 391,0 | |
А-  В-
В- 
| 10,79 | 0,0 10,0 20,0 33,3 40,0 50,0 60,0 100,0 | 0,0 3,0 8,0 34,0 47,0 82,0 96,0 100,0 | 391,1 395,1 399,5 401,6 400,3 393,3 378,0 358,3 | |
А-  В-
В- 
| 10,133 | 4,95 9,2 18,9 22,8 27,9 33,8 34,4 35,8 39,7 44,4 50,3 52,2 56,0 58,2 61,7 79,8 87,9 100,0 | 0,8 1,8 6,4 10,6 17,8 30,5 32,1 35,8 47,5 63,3 81,0 86,2 92,2 95,8 98,9 99,2 99,5 100,0 | 374,6 375,8 379,8 381,4 383,3 384,7 385,0 385,4 384,4 381,7 374,7 371,9 365,9 359,6 352,0 318,1 306,5 292,4 | |
А-  В-
В- 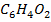 (фурфурол)
(фурфурол)
| 10,133 | 0,0 2,0 4,0 6,0 8,0 10,0 20,0 30,0 50,0 90,8 96,0 98,0 99,0 100,0 | 0,0 10,0 19,0 36,0 68,0 81,1 89,0 90,5 90,8 90,8 90,8 92,0 94,5 100,0 | 435,0 431,8 427,8 419,0 395,5 382,5 373,6 371,7 370,9 370,9 370,9 371,1 371,6 | |
А-  В-
В- 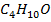 (н -бутиловый спирт)
(н -бутиловый спирт)
| 10,133 | 3,9 4,7 5,5 7,0 25,7 27,5 29,2 30,5 49,6 50,6 55,2 57,7 97,5 98,0 98,8 99,2 99,4 99,7 99,9 | 26,7 29,9 32,3 35,2 62,9 64,1 65,5 66,2 73,6 74,0 75,0 75,0 75,2 75,6 80,8 84,3 88,4 92,9 98,1 | 384,5 383,6 382,6 381,8 370,9 370,2 369,7 369,3 366,5 366,4 365,9 365,8 365,7 366,0 366,7 368,4 369,8 371,7 372,5 | |
А-  В-
В-  (изо -бутиловый спирт)
(изо -бутиловый спирт)
| 10,133 | 13,5 15,0 15,9 17,2 39,7 40,5 56,4 60,5 67,0 97,5 97,8 98,6 99,1 99,8 | 40,1 42,0 43,7 44,6 62,6 63,3 66,0 66,7 67,0 67,2 67,3 71,4 78,2 95,7 | 370,8 370,1 369,6 369,0 363,3 363,2 362,5 362,4 362,2 362,5 363,1 364,5 366,4 371,9 | |
А-  В-
В-  (2-метил-3-бутил-2-ол)
(2-метил-3-бутил-2-ол)
| 10,246 | 0,0 18,9 34,2 53,8 66,7 75,7 82,4 87,5 91,6 94,9 97,7 99,5 100,0 | 0,0 42,7 55,3 63,4 65,7 66,9 67,5 68,1 69,1 70,3 75,7 91,0 100,0 | 377,5 367,8 365,3 364,3 364,1 364,2 364,25 364,3 364,4 364,8 366,4 369,0 373,3 | |
А- 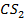 В-
В- 
| 10,133 | 0,0 1,9 4,8 13,4 18,6 29,1 38,0 44,8 53,6 65,3 78,9 87,9 96,8 100,0 | 0,0 8,3 18,5 35,1 44,3 52,8 57,4 59,8 62,7 66,1 70,5 76,0 88,6 100,0 | 329,2 327,0 324,4 319,6 317,0 314,4 313,3 312,8 312,3 312,1 312,3 313,5 316,5 319,3 | |
А-  В-CC
В-CC 
| 10,133 | 0,0 0,2 0,4 1,3 1,7 3,0 5,1 10,7 12,4 24,8 40,1 45,3 55,0 56,6 72,5 76,4 81,3 83,3 88,3 91,8 94,8 97,9 99,3 100,0 | 0,0 2,0 12,0 24,2 26,4 38,3 44,5 49,5 50,0 52,2 53,7 54,1 55,2 55,2 59,1 60,3 63,0 64,9 69,6 75,3 82,3 91,0 96,7 100,0 | 349,7 349,1 345,4 340,6 339,9 335,0 332,4 330,2 330,0 329,3 328,8 328,8 327,7 328,7 329,0 329,4 329,8 330,1 331,2 332,5 333,9 335,8 337,1 337,7 | |
А-  В-
В- 
| 9,67 | 0,0 2,4 3,6 4,7 5,9 6,3 9,2 24,9 64,5 78,5 84,7 90,2 94,1 98,3 100,0 | 0,0 17,5 30,1 43,5 51,1 53,4 54,6 59,9 64,5 66,5 71,3 77,1 84,4 93,6 100,0 | 351,6 341,2 336,9 333,3 330,7 330,3 329,8 329,4 329,4 329,9 330,6 330,3 332,6 334,9 336,1 | |
А-  В-
В- 
| 10,133 | 0,0 2,8 5,0 5,7 9,0 11,8 27,0 44,0 58,6 69,5 81,7 88,3 90,2 94,5 96,8 98,8 | 0,0 31,0 39,5 42,0 48,5 56,5 57,5 58,6 61,0 62,5 65,5 70,0 73,0 82,2 90,0 94,2 | 363,2 342,4 339,8 338,7 334,4 332,0 331,0 330,8 330,7 330,6 331,1 331,9 332,9 333,2 335,4 336,4 | |
А-  В-
В- 
| 10,0 | 0,0 4,0 15,9 29,8 42,1 53,7 62,9 71,8 79,8 87,2 93,9 100,0 | 0,0 15,1 35,3 40,5 43,6 46,6 50,5 54,9 60,6 68,3 78,7 100,0 | 352,8 348,2 342,5 341,5 340,8 341,0 341,4 342,0 343,3 344,8 347,4 351,1 | |
А-  В-
В- 
| 10,133 | 0,0 4,8 17,6 28,0 40,0 60,0 80,0 90,0 99,0 100,0 | 0,0 14,0 31,7 42,0 51,6 65,6 80,0 94,0 97,0 100,0 | 337,7 335,9 333,1 331,3 330,2 329,1 328,6 328,8 329,1 329,5 | |
А-  В-
В- 
| 9,76 | 0,0 7,9 14,3 18,6 26,6 39,4 46,2 53,6 61,8 71,5 77,0 82,1 91,5 100,0 | 0,0 6,0 11,6 16,0 23,5 39,4 52,0 59,8 69,8 79,2 84,8 90,1 95,4 100,0 | 332,9 333,3 334,2 334,8 335,2 335,4 335,0 334,3 333,3 331,9 331,2 330,2 329,0 328,2 | |
А-  В-
В- 
| 10,0 | 0,0 18,6 34,0 46,8 57,8 67,3 75,5 82,7 89,2 94,9 100,0 | 0,0 10,3 31,8 51,5 65,2 75,7 83,2 89,0 93,6 97,3 100,0 | 334,3 336,0 336,8 336,4 335,2 334,0 332,9 331,8 330,8 330,0 329,0 | |
А- 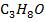 В-
В- 
| 10,133 | 0,0 1,0 2,0 4,0 6,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 85,0 90,0 96,0 100,0 | 0,0 11,0 21,6 32,0 35,1 37,2 39,2 40,4 42,4 45,2 49,2 55,1 64,1 70,4 77,8 90,0 100,0 | 373,0 368,0 365,0 363,5 362,3 361,5 361,1 360,9 360,8 360,9 361,3 362,0 363,5 364,5 365,8 367,0 370,3 | |
А-  (диэтиловый эфир)
В-
(диэтиловый эфир)
В-  (бутилацетат)
(бутилацетат)
| 0,668 | 0,0 18,0 28,2 35,5 37,0 43,5 59,1 76,5 86,8 92,1 100,0 | 0,0 22,5 32,2 36,3 37,0 41,6 50,4 64,5 75,2 83,3 100,0 | 325,6 324,5 324,1 323,8 323,7 323,8 324,2 325,3 326,5 327,7 329,1 | |
А-  (диэтиловый эфир)
В-
(диэтиловый эфир)
В-  (бутилацетат)
(бутилацетат)
| 2,2 | 0,0 16,1 31,3 47,4 61,3 77,7 87,3 100,0 | 0,0 21,0 37,5 47,9 57,8 70,5 80,7 100,0 | 353,6 351,2 349,9 349,4 349,5 350,2 351,3 353,3 | |
А-  (диэтиловый эфир)
В-
(диэтиловый эфир)
В-  (бутилацетат)
(бутилацетат)
| 10,133 | 0,0 21,9 37,2 51,4 66,4 72,2 77,9 84,7 89,6 100,0 | 0,0 33,4 48,2 58,0 69,2 74,1 78,6 84,4 88,0 100,0 | 399,0 394,2 391,9 390,9 390,1 389,9 389,8 390,0 390,1 390,5 | |
А-  В-
В- 
| 10,1 | 0,0 2,9 6,3 10,3 15,2 21,2 28,7 38,5 51,8 70,72 84,7 100,0 | 0,0 8,3 16,1 24,0 32,3 41,2 48,8 54,2 58,9 67,8 82,3 100,0 | 337,9 337,1 335,4 333,7 332,1 330,5 328,9 327,5 326,7 326,7 330,0 334,4 | |
А-  В-
В- 
| 9,93 | 0,0 3,2 7,0 11,4 16,6 23,0 31,0 41,1 55,67 63,0 72,9 89,0 100,0 | 0,0 16,6 26,5 35,4 43,5 49,8 53,6 56,9 59,7 63,0 66,9 84,0 100,0 | 350,9 347,8 345,4 343,3 341,4 339,6 338,3 337,4 336,9 336,6 337,3 343,0 348,9 | |
А-  В-
В- 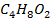
| 9,14 | 0,0 0,5 7,3 15,9 28,0 35,2 42,9 51,3 57,2 58,8 61,3 69,3 79,2 89,4 100,0 | 0,0 0,8 10,0 20,2 32,4 38,9 45,9 52,8 57,7 48,7 61,0 67,5 76,5 87,1 100,0 | 347,1 347,0 346,3 345,8 345,2 344,9 344,7 344,6 344,6 344,6 344,6 344,8 345,1 345,6 346,4 | |
А-  В-
В- 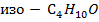 (изо -бутиловый спирт
(изо -бутиловый спирт
| 10,133 | 0,0 6,6 11,4 15,0 21,1 33,3 35,5 44,1 55,0 58,8 63,8 68,2 76,2 80,3 84,4 87,0 89,7 96,5 100,0 | 0,0 13,1 21,8 26,7 33,4 42,1 44,2 48,0 53,6 54,4 57,0 59,8 64,1 67,4 71,2 73,6 77,3 87,0 100,0 | 381,0 378,2 376,6 375,8 374,9 374,2 374,1 373,8 373,5 373,6 373,4 374,4 374,9 375,5 376,3 376,8 377,7 380,2 383,4 | |
А-  (транс -дихлорэтан
В-
(транс -дихлорэтан
В- 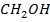
| 10,133 | 0,0 0,7 2,1 2,8 5,8 11,2 13,4 18,7 24,6 29,4 34,3 43,8 73,7 76,9 88,6 95,5 98,7 99,6 100,0 | 0,0 5,1 13,8 16,8 30,4 45,2 48,5 53,8 59,3 65,3 68,0 72,8 76,0 76,9 79,0 83,0 90,6 94,4 100,0 | 337,6 336,4 339,9 333,5 329,5 325,3 324,1 321,0 319,0 317,8 317,3 316,0 315,0 314,9 315,3 316,1 317,8 319,0 321,3 | |
А-  (цис -дихлорэтан
В-
(цис -дихлорэтан
В- 
| 10,133 | 0,0 2,9 4,8 7,0 13,6 16,9 19,6 25,9 31,4 36,5 40,0 42,6 51,3 57,1 65,1 70,5 85,0 91,6 98,6 99,6 99,8 100,0 | 0,0 8,9 13,7 18,7 33,1 37,1 39,1 45,4 50,4 53,9 55,9 57,6 60,9 63,4 65,1 65,5 70,8 74,0 84,0 87,3 93,9 100,0 | 337,6 336,3 334,8 333,6 331,0 329,9 329,0 327,5 326,7 326,1 325,6 325,4 325,0 324,8 324,5 324,8 325,5 325,9 328,4 329,3 330,8 333,3 |
Таблица 3
| № варианта | Т1 | а | b | c |
| 61,2 | 38,8 | |||
| 67,4 | 32,6 | |||
| 15,8 | 84,2 | |||
| 19,6 | 80,4 | |||
| 68,8 | 31,2 | |||
| 6,4 | 93,6 | |||
| 30,4 | 69,6 | |||
| 27,1 | 72,9 | |||
| 62,2 | 37,8 | |||
| 43,6 | 56,4 | |||
| 334,5 | 37,2 | 62,8 | ||
| 37,2 | 62,8 | |||
| 54,2 | 45,8 | |||
| 350,5 | 65,5 | 34,5 | ||
| 54,2 | 45,8 | |||
| 330,3 | 55,5 | 44,5 | ||
| 36,8 | 63,2 | |||
| 345,5 | 52,7 | 47,3 | ||
| 83,4 | 16,6 | |||
| 50,5 | 49,5 | |||
| 50,5 | 49,5 |
Методические указания к выполнению задач
Задача №1
1. Тепловой эффект химической реакции изобарного процесса можно определить на основании первого следствия из закона Гесса описываемого уравнением:
 , (1)
, (1)
где  -стехиометрический коэффициент;
-стехиометрический коэффициент;
 ,
,  - суммы стандартных тепловых эффектов образования конечных и исходных веществ реакции;
- суммы стандартных тепловых эффектов образования конечных и исходных веществ реакции;
 - тепловой эффект образования веществ из простых веществ в стандартных условиях при температуре 298 К. За стандартные условия принято состояние вещества в чистом виде при атмосферном давлении. Стандартное состояние вещества обозначается верхним индексом "0".
- тепловой эффект образования веществ из простых веществ в стандартных условиях при температуре 298 К. За стандартные условия принято состояние вещества в чистом виде при атмосферном давлении. Стандартное состояние вещества обозначается верхним индексом "0".
При расчете тепловых эффектов химических реакций при заданной температуре можно воспользоваться приводимыми в таблицах средними значениями теплоемкостей в температурном интервале от 298 до Т:
 , (2)
, (2)
где  - изменение теплоемкости в ходе химической реакции;
- изменение теплоемкости в ходе химической реакции;
 , (3)
, (3)
 ,
,  - суммы теплоемкостей конечных и исходных веществ.
- суммы теплоемкостей конечных и исходных веществ.
2. В химической технологии о направлении процесса и равновесии в системе при постоянных давлении и температуре судят по энергии Гиббса. Энергия Гиббса системы при постоянных р и Т уменьшается при необратимых процессах и остается постоянной при обратимых процессах 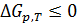 . Равновесное состояние системы соответствует минимуму энергии Гиббса, поэтому условием равновесия при постоянных р и Т будет
. Равновесное состояние системы соответствует минимуму энергии Гиббса, поэтому условием равновесия при постоянных р и Т будет  .
.
При уменьшении энергии Гиббса химическая реакция протекает самопроизвольно в сторону образования продуктов. В случае увеличения энергии Гиббса,  , реакция самопроизвольно идти не может.
, реакция самопроизвольно идти не может.
Изменение энергии Гиббса реакции определим по уравнению:
 , (4)
, (4)
где  ,
,  - изменение энергии Гиббса при температуре Т и 298 К соответственно, Дж/(моль∙К);
- изменение энергии Гиббса при температуре Т и 298 К соответственно, Дж/(моль∙К);
 - изменение энтропии процесса, Дж/(моль∙К).
- изменение энтропии процесса, Дж/(моль∙К).
Для химической реакции изменение энтропии  рассчитывают по уравнению:
рассчитывают по уравнению:
 , (5)
, (5)
где  ,
,  - суммы абсолютных энтропий конечных и исходных веществ.
- суммы абсолютных энтропий конечных и исходных веществ.
Изменение энергии Гиббса при стандартном состоянии вещества можно определить по уравнению:
 , (6)
, (6)
где 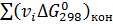 ,
,  - суммы энергий Гиббса образования для конечных и исходных веществ, Дж/(моль∙К).
- суммы энергий Гиббса образования для конечных и исходных веществ, Дж/(моль∙К).
3. Расчет энергии Гиббса,  , для реакции при стандартном состоянии и 298 К:
, для реакции при стандартном состоянии и 298 К:
 , (7)
, (7)
где  - энтальпия реакции при стандартных условиях и 298 К, Дж/(моль∙К);
- энтальпия реакции при стандартных условиях и 298 К, Дж/(моль∙К);
 - энтропия химической реакции при стандартных условиях и 298 К, Дж/(моль∙К).
- энтропия химической реакции при стандартных условиях и 298 К, Дж/(моль∙К).
Энтальпию и энтропию химической реакции можно определить на основании уравнений (1) и (5) соответственно.
Константу равновесия, 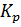 , определяем по уравнению:
, определяем по уравнению:
 , (8)
, (8)
где  - универсальная газовая постоянная, 8,314 кДж/(моль∙К).
- универсальная газовая постоянная, 8,314 кДж/(моль∙К).
Задача №2
1. По данным состава жидкой и паровой фаз строится график состава пара от состава жидкой фазы при постоянном давлении. По оси абсцисс откладывается молярная доля компонента А в жидкой фазе, а по оси ординат - в паровой фазе в одинаковом масштабе.
2. При построении диаграммы по оси абсцисс откладывается молярная доля компонента А от 0 % до 100 %, а в обратном направлении откладывается, соответственно, компонент В. По оси ординат отмечается температура смеси.
3. На оси абсцисс, в соответствии с вариантом задания, находим точку с молярной долей а % вещества А. Из найденной точки проводим вертикальную линию до пересечения с изотермой кипения системы А-В. Из точки пересечения соединяем горизонтальной линией с осью ординат и определяет температуру кипения системы.
4. На диаграмме, построенной в п. 2, проводим горизонтальную линию соответствующую температуре Т1 варианта задания. В точке пересечения с изотермой пара определяем состав пара, находящегося в равновесии с жидкой фазой.
5. По диаграмме кипения системы А-В определяем имеется ли на диаграмме азеотропная точка и какой компонент можно выделить из системы.
Сначала рассчитаем количество молей в 1 кг исходной системы. Для этого определим среднюю молекулярную массу исходного раствора с молярной долей а % вещества А:
 ,
,
где МА, МВ - молекулярная масса вещества А и В.
В 1 кг раствора содержится  моль. В 1 кг раствора находится
моль. В 1 кг раствора находится  моль компонента А и
моль компонента А и  моль компонента В.
моль компонента В.
Предположим, что имеется азеотропная точка и данный состав находится справа от этой точки и выделить ректификацией в чистом виде можно только компонент А. Весь компонент В в количестве  перейдет в азеотропную смесь с молярным содержанием с % определяемым по диаграмме кипения. Молярная доля с % определяется как равновесное состояние пара соответствующей молярной доли а % в жидкости. Остальные
перейдет в азеотропную смесь с молярным содержанием с % определяемым по диаграмме кипения. Молярная доля с % определяется как равновесное состояние пара соответствующей молярной доли а % в жидкости. Остальные  % в азеотропном растворе составит компонент А:
% в азеотропном растворе составит компонент А:


Следовательно, в азеотропную смесь перейдет х моль компонента А, а в чистом виде можно выделить  моль, или
моль, или
 кг компонента А.
кг компонента А.
Литература:
1. Барон, Н. М. Краткий справочник физико-химических величин/ Н. М. Барон, А. М. Пономарева, А. А. Равдель и др. - СПб.: Изд-во "Иван Федеров", 2003 - 240с.
2. Ипполитов, Е.Г. Физическая химия: учебник/ Е. Г. Ипполитов, А. В. Артемов, В. В. Батраков. -М.:РИЦ "Академия", 2005.-448с.
3. Кудряшов, И. В. Сборник примеров и задач по физической химии/ И. В. Кудряшов, Г. С. Каретников -М.: Высшая школа, 1991.-527с.
4. Физическая химия: учеб. пособие для студ. всех спец. / Н. В. Архипова и др. - Саратов: СГТУ, 2009. - 160 с.
5. Стромберг, А. Г. Физическая химия: Учебник для вузов / Под ред. А. Г. Стромберга. - М.: Высш. шк., 2001. 527 с.
6. Практические работы по физической химии: Учеб. пособие для вузов / Под ред. К. П. Мищенко, А. А. Равделя, А. М. Пономаревой. - СПБ: Профессия, 2002. - 384 с.
Приложение
Таблица 4 Термодинамические величины для простых веществ
| Вещество |  кДж/моль
кДж/моль
|  Дж/моль·град
Дж/моль·град
| Теплоемкость, Дж/моль·град | |||
Коэффициенты уравнения 
| 
| |||||
| a | b·103 | c'·10-5 | ||||
| Простые вещества | ||||||
| Cl2 | 223,0 | 36,69 | 1,05 | -2,52 | 33,84 | |
| H2(г) | 130,6 | 27,28 | 3,26 | 0,502 | 28,83 | |
| N2 | 191,5 | 27,87 | 4,27 | - | 29,1 | |
| O2 | 205,03 | 31,46 | 3,39 | -3,77 | 29,36 | |
| S(ромб) | 31,88 | 14,98 | 26,11 | - | 22,6 | |
| Неорганические соединения | ||||||
| СО(г) | -110,5 | 197,4 | 28,41 | 4,1 | -0,46 | 29,15 |
| СО2(г) | -393,51 | 213,6 | 44,14 | 9,04 | -8,53 | 37,13 |
| СОСl2(г) | -223,0 | 289,2 | 67,16 | 12,11 | -9,03 | 60,67 |
| CaCO3 | -1206 | 92,9 | 104,5 | 21,92 | -25,94 | 81,85 |
| CaO(кр) | -635,1 | 39,7 | 49,63 | 4,52 | -6,95 | 42,8 |
| Ca(OH)2 | -986,2 | 83,4 | 105,2 | 12,0 | -19,0 | 87,5 |
| HCl | -92,3 | 186,7 | 26,53 | 4,6 | 1,09 | 29,16 |
| H2O(г) | -241,84 | 188,74 | 30,00 | 10,71 | 0,33 | 33,56 |
| H2O(ж) | -285,84 | 69,96 | - | - | - | 75,31 |
| MgO | -601,24 | 26,94 | 42,59 | 7,28 | -6,19 | 37,41 |
| Mg(OH)2 | -924,66 | 63,14 | 54,56 | 66,11 | - | 76,99 |
| NH3 | -46,19 | 192,5 | 29,8 | 25,48 | -1,67 | 35,65 |
| NH4Cl | -315,39 | 94,56 | 49,37 | 133,89 | - | 84,1 |
| NO | 90,37 | 210,62 | 29,58 | 3,85 | -0,59 | 29,83 |
| NO2 | 33,89 | 240,45 | 42,93 | 8,54 | -6,74 | 37,11 |
| N2O4 | 9,37 | 304,3 | 83,89 | 39,75 | -14,9 | 78,99 |
| SO2 | -296,9 | 248,1 | 42,55 | 12,55 | -5,65 | 39,87 |
| SO2Cl2 | -358,7 | 311,3 | 53,72 | 79,5 | - | 77,4 |
| SO3 | -395,2 | 256,23 | 57,32 | 26,86 | -13,05 | 50,63 |
Таблица 5 Термодинамические величины для органических веществ
| Вещество |  кДж/моль
кДж/моль
|  Дж/моль·град
Дж/моль·град
| Теплоемкость, Дж/моль·град | ||||
Коэффициенты уравнения 
| 
| ||||||
| a | b·103 | c·106 | d·109 | ||||
| CH4 | -74,85 | 186,19 | 17,45 | 60,46 | 1,117 | -7,2 | 35,79 |
| C2H4 | 52,28 | 219,4 | 4,196 | 154,59 | -81,09 | 16,82 | 43,63 |
| C2H6 | -84,67 | 229,5 | 4,494 | 182,26 | -74,86 | 10,8 | 52,7 |
| C6H6 | 49,04 | 173,2 | 59,5 | 255,02 | - | - | 136,1 |
| C6H12 | -123,1 | 298,2 | -51,72 | 598,8 | -230,0 | - | 106,3 |
| CH4O(ж) | -238,7 | -126,7 | - | - | - | - | 81,6 |
| C2H4O(г) | -166,0 | 264,2 | 13,00 | 153,5 | -53,7 | - | 54,64 |
| C2H6O(ж) | -277,6 | 160,7 | - | - | - | - | 111,4 |