Раздел 1. «Термодинамика»
Занятие №11. «Изотермический, адиабатный и политропный процесс»
Изотермический процесс. Примером изотермического процесса может служить процесс, проходящий с газом, который находится в цилиндре с подвижным поршнем, когда объем газа увеличивается настолько, чтобы температура его оставалась неизменной.
Уравнение изотермического процесса: Т =const.
Графическое изображение процесса приведено на рис. 1.

Рис. 1. Диаграммы изотермического процесса
3. Связь между параметрами. Из уравнения
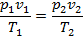
при Т 1 = Т 2 = Т имеем
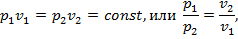
т. е. в изотермическом процессе отношение абсолютных давлений обратно пропорционально отношению удельных объемов.
4. Изменение удельной внутренней энергии в изотермическом процессе равно нулю, так как он протекает без изменения температуры:

5. Удельная работа

Для произвольной масс работа А равна

6. Удельная теплота процесса

Для произвольной массы теплота равна
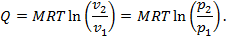
т. е. все подведенное количество теплоты в изотермическом процессе расходуется на совершение внешней механической работы.
7. Изменение энтропии Δ s при Т 1 = Т 2 = Т определяют по выражению
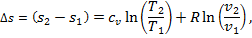
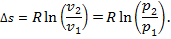
Адиабатный процесс. Процесс, протекающий без подвода или отвода теплоты, т. е. без теплообмена с окружающей средой, называется адиабатным. Примером адиабатного процесса является процесс сжатия или расширения газа в цилиндре, покрытом абсолютно теплонепроницаемой изоляцией (абсолютной теплоизоляции нет). Если процесс протекает быстро, то теплообмен между рабочим телом и окружающей средой незначителен, и такой процесс можно считать адиабатным.
Адиабатные процессы расширения и сжатия осуществляются только за счет изменения внутренней энергии газа. Адиабатными можно считать процессы в быстроходных двигателях внутреннего сгорания; при истечении газов с большими скоростями и др.
1. Уравнение адиабатного процесса: s = const. Поскольку

2. Графическое изображение процесса приведено на рис. 2.
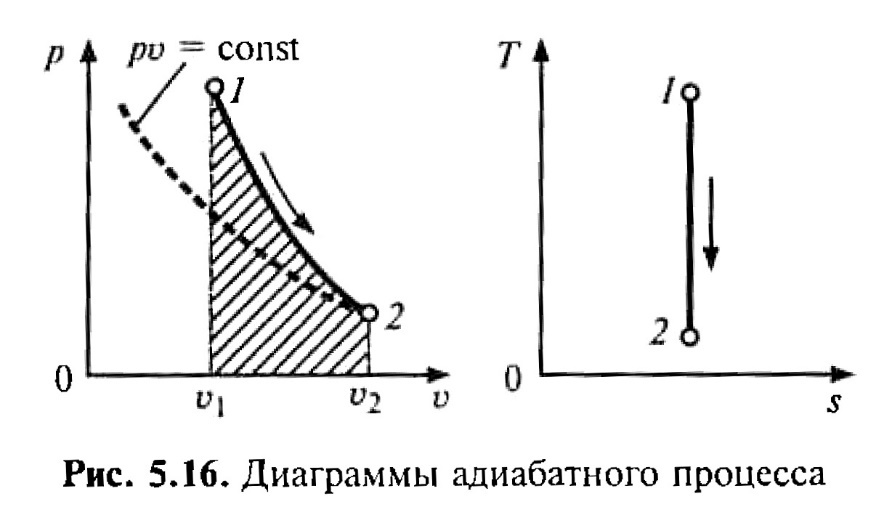
Рис. 2. Диаграммы адиабатного процесса
3. Связь между параметрами определяется выражением

где 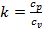 – показатель адиабаты.
– показатель адиабаты.
Поскольку
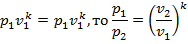
следовательно
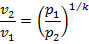
Из выражений
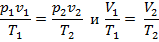
имеем

Или
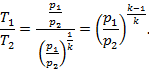
4. Изменение удельной внутренней энергии, как и для других процессов равно
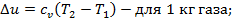
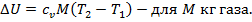
5. При адиабатном процессе q= 0, так как площадь на Т,s – диаграмме под прямой процесса равна нулю.
6. Работа, совершаемая в адиабатном процессе,

Удельная работа совершается газом за счет его внутренней энергии (понижаются р и Т). При адиабатном сжатии внешняя работа идет на увеличение его внутренней энергии (р и Т повышаются).
7. Δ s = 0.
Политропный процесс. В действительных процессах происходит изменение сразу всех параметров. Кривые, описывающие реальные процессы, называют политропами, а процессы политропными.
1. Уравнение политропного процесса:

где 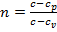 — показательполитропы, – ∞ < n < + ∞; с — постоянная для данного процесса теплоемкость.
— показательполитропы, – ∞ < n < + ∞; с — постоянная для данного процесса теплоемкость.
Изменяя значение п, можно получить частные случаи политропного процесса:
а) если п = 0, то v 0 = 1, следовательно р = const— изобарный процесс;
б) если п = ±∞, то уравнение pvn = const можно представить в следующем виде:
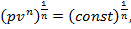
отсюда 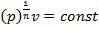 — изохорный процесс;
— изохорный процесс;
в) если п = k, то уравнение pvn = const превращается в уравнение pvk = const — адиабатный процесс;
г) если n = 1, то pv=const или Т = const, что соответствует уравнению изотермического процесса.
2. Графическое изображение политропного процесса представлено на рис. 3.
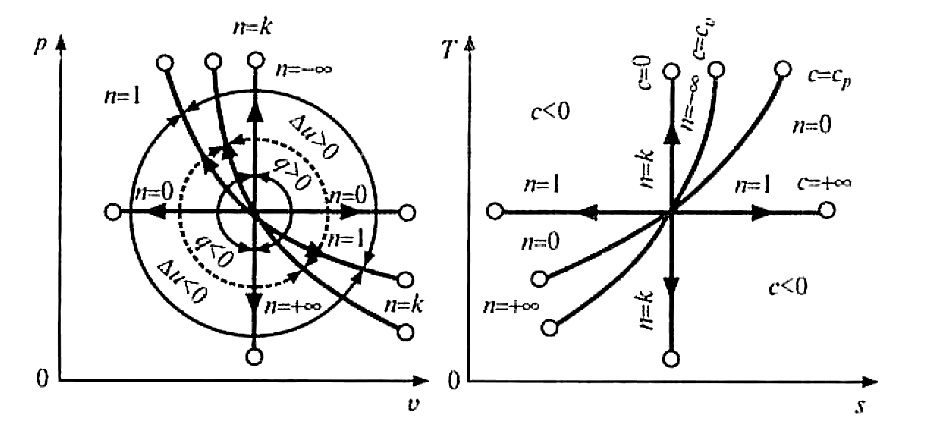
Рис. 3. Изображение основных термодинамических процессов
При п >k политропа идет круче адиабаты. При п < 1политропа идет выше изотермы (на участке). Это означает, что теплота Q системе сообщается больше, чем при изотермическом процессе, но меньше, чем при изобарном процессе.
Помимо четырехчастных случаев можно представить бесконечное множество процессов при
– ∞ < n < + ∞, каждая линия будет характеризовать свой процесс.
Связь между параметрами выражается уравнениями, аналогичными с адиабатным процессом, только вместо показателя k используется показатель п:
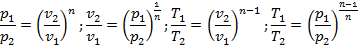
4. Изменение удельной внутренней энергии для всех процессов определяется по формуле
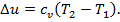
5. Удельная работа, совершаемая в политропном процессе, определяется по аналогии с адиабатным процессом:
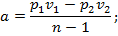


6. Количество удельной теплоты qn в политропном процессе

где с п — удельная теплоемкость в политропном процессе,

где п, k соответствуют показателям политропы и адиабаты.
7. Изменение удельной энтропии имеет вид

Вопросы и задания
1. Приведите пример изотермического процесса.
2. Какой процесс является адиабатным?
3. Приведите пример адиабатного процесса. *Какие еще процессы можно считать адиабатными?
4. Выполните таблицу следующей формы:
Сравнение изотермического и адиабатного процессов
| № п.п. | Условия, параметры, рисунки и т.п. | Для изохорного процесса | Для изобарного процесса |
| Уравнение процесса | |||
| Графическое изображение процесса | |||
| Связь между параметрами (приводите только окончательную (е) формулу (ы)) | |||
| Изменение удельной внутренней энергии | |||
| Работа, совершаемая в процессе | |||
| Удельная теплота процесса | |||
| Изменение энтропии Δ s |
5. Чем характерны действительные процессы, как называются данные процессы и их кривые?
6. Напишите уравнение политропного процесса с расшифровкой его составляющих.
7*. Какие бывают частные случаи политропного процесса и какой параметр должен изменятся для их получения?
8**. Изобразите политропный процесс и приведите его описание.
9*. Какими уравнениями выражаетсясвязь между параметрами?
10*. По какой формулеопределяетсяизменение удельной внутренней энергии для всех процессов?
11*. Как совершаемая удельная работав политропном процессе? ** Запишите формулы.
12*. Как определяется количество удельной теплоты в политропном процессе?
13*. Запишите формулу изменения удельной энтропии в политропном процессе.