ЗАДАНИЕ
1. Ознакомиться с теоретическим положением.
2. В рабочей тетраде произвести расчёт термодинамического процесса согласно варианту (номер по списку в журнале), используя исходные данные (таблица 1, 2 и 3). Расчёт проводится в следующем порядке:
- записывается уравнение процесса;
- устанавливается зависимость между параметрами в процессе;
- определяется неизвестные параметры;
- определяется работа в процессе;
- определяется теплота, необходимая для осуществления процесса;
- определяется изменение энтальпии и энтропии между начальным и конечным состояниями процесса (на оценку «Отлично»).
3. Ответить на контрольные вопросы:
Таблица 1
Исходные данные для расчета термодинамического процесса изотермического сжатия газа при заданных параметрах
| Вариант | Газ | Р 1, МПа | Р 2, МПа | T 1 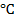
|
| Бутан Пропан Аргон Кислород Водород Этилен Азот Ацетилен Аммиак Водород | 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0,4 0,5 |
Таблица 2
Исходные данные для расчета изохорного процесса для газа при заданных параметрах
| Вариант | Газ | V 1, м3 | Р 1, МПа | T 1 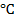
| T 2 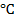
|
| Азот Аммиак Водород Гелий Кислород Метан Пропан Хлор Этан Этилен | 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0,4 0,5 |
Таблица 3
Исходные данные для расчета адиабатного процесса сжатия водорода при заданных параметрах
| Вариант | V 1, м3 | V 2, м3 | Р 1, МПа | T 2 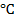
|
| 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0,4 0,5 | 3,5 4,5 |
Теоретическое обоснование
Последовательно изменение состояния тела, происходящее в результате энергетического взаимодействия рабочего с окружающей его средой, называется термодинамическим процессом. В термодинамическом процессе обязательно изменяется хотя бы один параметр состояния.
Простейшими или термодинамическими процессами являются:
Изохорный (v = const), изобарный (P = const), изотермический (T = const) и адиабатный (процесс без внешнего теплообмена).
Для расчётов термодинамических процессов используют первый закон термодинамики, которому можно дать такую формулировку: в термодинамическом процессе подведенная теплота в общем случае расходуется на изменение внутренней энергии и на совершение внешней работы:
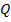 =
= 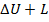
Для 1 кг вещества выражение закона термодинамики запишется так:
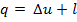
Или в дифференциальной форме:
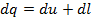
Следует обратить внимание на то, что хотя величины входящие в уравнение первого закона термодинамики имеют одинаковую размерность, физические понятия определяющие эти величины глубоко различны. Внутренняя энергия представляет собой энергию, накопленную телом (системой), а работа и теплота – энергию, которая сообщается или отнимается от тела в каком-либо процессе.
Задачей расчёта любого термодинамического процесса является установление закономерностей изменения параметров состояния рабочего тела, и выявления особенностей превращения энергии.
Расчёт проводится в следующем порядке:
- записывается уравнение процесса;
- устанавливается зависимость между параметрами в процессе;
- определяется неизвестные параметры;
- определяется работа в процессе;
- определяется теплота, необходимая для осуществления процесса;
- определяется изменение энтальпии и энтропии между начальным и конечным состояниями процесса (на оценку «Отлично»).
Изотермический процесс
Уравнение изометрического процесса:
PV = RT = const
Откуда
P 1 V 1 = RT 1→ V 1 = RT 1/ P 1
Соотношение параметров:
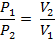
Откуда
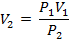
Изменение внутренней энергии и энтальпии:
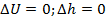
Т.к. d T = 0. Следовательно, вся подведенная в процессе теплота расходуется только на работу.
Работа в процессе определяется по формуле:
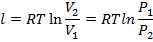
Теплоту в процессе можно определить, также используя энтропию:
q = T (S 2 – S 1)
т.е. в изометрическом процессе достаточно определить теплоту или работу, т.к.
q = l
Изменение энтропии при T 1 = T 2 определяется по формуле:
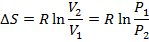
Изохорный процесс
Уравнение изохорного процесса:
P / T = const, при V = const
Соотношение параметров в изохорном процессе:
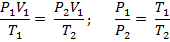
Откуда
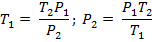
Изменение внутренней энергии определяется по формуле:
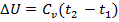 , (кДж/кг)
, (кДж/кг)
где Сv – массовая изохорная теплоемкость газа (Дж/кг∙К).
В изохорном процессе d V = 0 и термодинамическая работа не совершается L = 0. Поэтому вся теплота расходуется на изменение внутренней энергии, т.е.
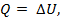 (кДж)
(кДж)
Изменение энтальпии может быть найдено из общего выражения для всех процессов:
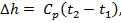 (кДж/кг)
(кДж/кг)
где С р – изобарная массовая теплоёмкость (кДж/кг∙К)
Изменение энтропии с учётом того, что V 1 = V 2
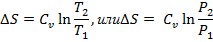
Изобарный процесс
Уравнение изохорного процесса:
V / T = const, при P = const
Соотношение параметров в изобарном процессе:
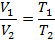
Работа в процессе, отнесенная на 1 кг газа определяется по формуле:
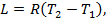 (Дж/кг)
(Дж/кг)
Если в изобарном процессе изменяется температура 1 кг на 1К, то 1 = R, т.е. газовая постоянная – это работа 1 кг газа в изобарном процессе при изменении температуры на 1К.
Количество теплоты в изобарном процессе:
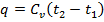 , (Дж/кг)
, (Дж/кг)
Изменение энтальпии:
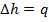
Изменение энтропии:
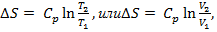 (Дж/кг)
(Дж/кг)
Адиабатный процесс
Уравнение адиабатного процесса:
PVk = const,
где k – показатель адиабаты.
Соотношение параметров, полученные из уравнения процесса:
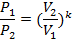
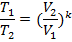
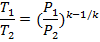
Выражение для работы в процессе может быть получено из первого закона термодинамики, с учётом того, что q =0:
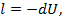 или
или 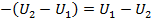
Т.е. в адиабатном процессе работа совершается за счёт убыли внутренней энергии. Работу можно определить по формулам:
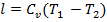
Или с учётом
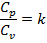
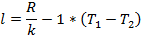
Подставим из уравнения состояния T1 и Т2:
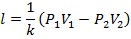
Или
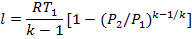
Изменение энтальпии находится по общему выражению.
Изменение энтропии равно 0, т.к. d q = 0
d S = d q / T = 0
Следовательно, в адиабатном процессе s = const. Поэтому обратимый адиабатный процесс называется изоэнтропийным.
Контрольные вопросы:
1. Перечислите основные термодинамические процессы.
2. Сформулируйте первый закон термодинамики.
3. В каком термодинамическом процессе
- не совершается работа?
- не происходит теплообмен
- не изменяется внутренняя энергии?
Значения удельных газовых постоянных, 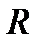 , кДж/(кг∙К)
, кДж/(кг∙К)
| Газ | Значение |
| Бутан | |
| Пропан | |
| Аргон | |
| Кислород | |
| Воздух | |
| Этилен | |
| Азот | |
| Ацетилен | |
| Водяной пар (100°С) | |
| Аммиак | |
| Водород |