Гидролиз солей
Степень гидролиза – это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ. Обычно, ее обозначают через hгидр (или α) (показывает, какая часть соли, содержащаяся в растворе (СМ), подверглась гидролизу (СМ гидр)):
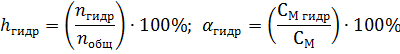
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше Кгидр, тем необратимее гидролиз. Кгидр имеет свое выражение для каждого случая гидролиза.
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН – соответственно, кислота и основание, которые образуют данную соль:
МА + Н2О ↔ НА + МОН
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
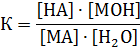
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
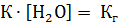
тогда для константы гидролиза соли Кг будет иметь такой вид:
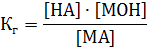
Зная константу гидролиза, можно определить рН среды:
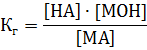
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда:
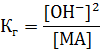
Используя это выражение можно вычислить рН раствора

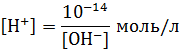
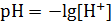
Вычисление рН растворов кислот и оснований
Для вычисления рН растворов кислот и оснований следует предварительно вычислить молярную концентрацию свободных ионов водорода ([Н+]) или свободных гидроксил ионов ([ОН-]), а затем воспользоваться формулами:
pH = -lg[H+]; pOH = -lg[OH-]; pH + pOH = 14
Концентрация любого иона в моль/л в растворе электролита можно вычислить по уравнению:
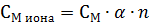
где См иона - молярная концентрация иона в моль/л;
См - молярная концентрация электролита в моль/л;
α - степень диссоциации электролита;
n - количество ионов данного вида, которое получается при распаде одной молекулы электролита.
Если электролит слабый, то значение степени диссоциации может быть определено на основании закона разбавления Оствальда:
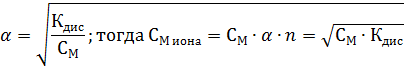
| Задание 1. Вычислить рН 0,001 н раствора гидроксида натрия. |
Решение.
Гидроксид натрия является сильным электролитом, диссоциация в водном растворе происходит по схеме:
NaOH → Na+ + OH-
Степень диссоциации в разбавленном растворе можно принять равной 1. Концентрация ионов ОН- (моль/л) в растворе равна:
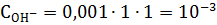
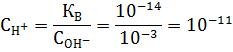
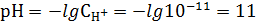
|
| Задание 2. Вычислить рН 1%-ного раствора муравьиной кислоты, считая, что плотность раствора равна 1 г/мл; Кдис = 2,1*10-4 |
Решение.
1 л раствора содержит 10 г НСООН, что составляет 10/46 = 0,22 моль, где 46 г/моль - молярная масса муравьиной кислоты. Следовательно, молярная концентрация раствора равна 0,22 моль/л. Муравьиная кислота - слабый электролит, поэтому
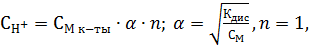 так как
НСООН ↔ Н+ + НСОО-, так как
НСООН ↔ Н+ + НСОО-,
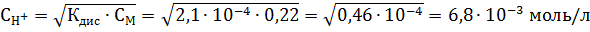 рН = -lg[H+] = -lg 6,8*10-3 = 3-lg 6,8 = 3 - 0,87 = 2,13
рН = -lg[H+] = -lg 6,8*10-3 = 3-lg 6,8 = 3 - 0,87 = 2,13
|
| Задание 3. | Решение |
| Рассчитайте константу гидролиза, степень гидролиза и рН 0,1 М раствора NaClO | Гидролиз по аниону:
NaClO + H2O ↔ HClO + NaOH, pH > 7.
Определим константу гидролиза.
Кг = Кw/K(HClO) = 10-14/2,95*10-8 = 3,34*10-7
Определим степень гидролиза.
α = (Кг/См)1/2 = (3,34*10-7/0,1)1/2 = 1,84*10-3 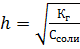 Определим рН
[ОН-] = h*См = 1,84*10-3*0,1 = 1,84*10-4
рОН = -lg[OH-] =3,73
pH = 14 – pOH = 10,27
Определим рН
[ОН-] = h*См = 1,84*10-3*0,1 = 1,84*10-4
рОН = -lg[OH-] =3,73
pH = 14 – pOH = 10,27
|
| Задание 4. | Решение |
| Определить какие соли из перечисленных подвергаются гидролизу, какие из них по катиону, какие по аниону, какие и по катиону и по аниону. NaCl, KI, Rb2SO4, Ba(ClO4)2, K2CO3, KCN, K2SO3, FeCl3, NH4Cl, CuCl2, (NH4)2CO3. | Гидролиз по катиону не идет, если катион образует сильное основание (щелочь). Это: щелочные, щелочноземельные металлы и серебро. Li+, Na+, K+, Rb+, Cs+, Ca2+, Sr2+, Ba2+, Ag+. Гидролиз по аниону не идет, если анион - кислотный остаток сильной кислоты. Это: галогеноводороды (кроме HF), серная, азотная, хлорная кислоты. HCl, HBr, HI, H2SO4, HNO3, HClO4 Отсюда: 1. Соли NaCl, KI, Rb2SO4, Ba(ClO4)2, образованы сильной кислотой и сильным основанием. Не гидролизуются. 2. Соли K2CO3, KCN, K2SO3, образованы сильным основанием и слабыми кислотами. Гидролиз по аниону. 3. Соли FeCl3, NH4Cl, CuCl2, образованы слабым (малорастворимым) основанием и сильной кислотой. Гидролиз по катиону. 4. (NH4)2CO3. Образован слабым основанием и слабой кислотой. Гидролиз по катиону и аниону. |
| Задание 5. | Решение |
| Записать уравнения гидролиза солей, определить среду раствора. NaCl, KCN, K2CO3, NH4Cl, CuCl2, Al2(SO4)3, Al2S3. | 1. NaCl не гидролизуется. 2. KCN - гидролиз по аниону. KCN + H2O ↔ KOH + HCN CN- + H2O ↔ OH- + HCN. Щелочная среда. 3. K2CO3 - гидролиз по аниону. В случае многоосновных кислот (оснований) гидролиз идет ступенчато. а) Первая ступень: K2CO3 + H2O ↔ KOH + KHCO3 CO32- + H2O ↔ HCO3- + OH- б) Вторая ступень: KHCO3 + H2O ↔ KOH + H2CO3 HCO3- + H2O ↔ H2CO3 + OH- 4. NH4Cl. Гидролиз по катиону. NH4Cl + H2O ↔ NH3*H2O + HCl NH4+ + H2O ↔ NH3*H2O + H+ (NH3*H2O иногда пишут в виде NH4OH, что по современным представлениям не вполне точно). 5. CuCl2. Гидролиз по катиону. а) Первая ступень. CuCl2 + H2O ↔ Cu(OH)Cl + HCl Cu2+ + H2O ↔ CuOH+ + H+ б) Вторая ступень. Cu(OH)Cl + H2O ↔ Cu(OH)2 + HCl CuOH+ H2O ↔ Cu(OH)2 + H+. Кислая среда. 6. Al2(SO4)3. Гидролиз по трем ступеням. а) Первая ступень: Al3+ + H2O → AlOH2+ + H+ Al2(SO4)3 + 2H2O → 2AlOHSO4 + H2SO4 б) Вторая ступень: AlOH2+ + H2O → Al(OH)2+ + H+ 2AlOHSO4 + 2H2O → (Al(OH)2)2SO4 + H2SO4 в) Третья ступень: Al(OH)2+ + H2O → Al(OH)3 + H+ (Al(OH)2)2SO4 + 2H2O → 2Al(OH)3 + H2SO4 Заметим, что на практике гидролиз идет главным образом только по первой ступени. Отдельно стоит соединение Al2S3, соль образована слабой кислотой и слабым основанием. В этом случае идет полный необратимый гидролиз. Al2S3 + 6H2O = 2Al(OH)3 + 3H2S↑ |