Лабораторная работа № 8
Сравнительный анализ показателей жесткости воды
Цель: сравнить результаты определений жесткости воды методом комплексонометрии и методом кислотно-основного титрования.
Посуда и реактивы: бюретка, колбы для титрования, пипетка, мерный цилиндр, раствор индикатора хромогена черного, метилоранж, аммиачный буфер, раствор соляной кислоты, исследуемая вода, Трилон Б.
Задание: выполнить опыты, оформить отчет.
Правила техники безопасности:
1. Правила работы с реактивами.
2. Правила работы с химической посудой.
Методические рекомендации к выполнению лабораторной работы:
Метод основан на связывании ионов НСО3- и СО32- кислотой в присутствии метилоранжа. При титровании протекают реакции:
СО32- + НСО3-; НСО3- + Н+ = CO2 + H2O
Определение общей жесткости воды, обусловлено присутствием в ней ионов кальция и магния
Ход работы
1. В коническую колбу на 250мл пипеткой отобрать 100мл исследуемой воды, добавить 5мл аммиачной буферной смеси и на кончике лопатки (несколько крупинок) индикатора. Окрашенный раствор титровать рабочим раствором трилона Б до перехода вишнево-красной окраски в синюю. Внимание! Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б следует прибавлять по каплям. Записать результаты титрования.
Расчет. Общую жесткость воды рассчитать по формуле, используя закон эквивалентов для растворов:
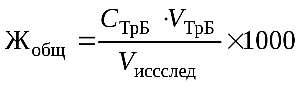
где С ТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; V ТрБ — объем трилона Б, пошедший на титрование; V исслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
2. В коническую колбу на 250мл пипеткой отмерить 100мл исследуемой воды, прилить 2 капли метилоранжа. Оттитровать пробу 0,1н рабочим раствором соляной кислоты до перехода желтой окраски в оранжевую. Записать результаты титрования.
Расчет. жесткость воды рассчитать по формуле, используя закон эквивалентов для растворов:
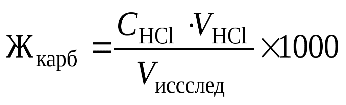 ,
,
где Жк - карбонатная жесткость, мг-экв/л; Сн(НС1) - нормальность рабочего раствора соляной кислоты, мл; V(HC1) - объем соляной кислоты, пошедший на титрование, мл; V(иссл) - объем пробы воды, мл.
Произвести вычисления и сделать вывод по работе:
Контрольные вопросы
1. Что называется жесткостью? Укажите единицы измерения жесткости.
2. Перечислите классы жесткости, виды жесткости.
3. Каким образом количественно определяют жесткость воды?
4. Какой буферный раствор в данной работе?
5. Привести расчетную формулу жесткости, в каких единицах выражается жесткость?
6. Какие особенности комплексонометрического метода?
7. Какой применяется индикатор и в каких условиях?
8. Какие катионы обуславливают общую и временную жесткость?
9. Техника безопасности при выполнении работы.
Методические рекомендации к работе № 1
Жесткость воды обусловлена наличием в ней растворимых солей кальция, магния. Жесткостью называется количество мг-экв ионов Са2+, Mg2+, содержащихся в 1л воды. 1 мг-экв (русский градус жесткости) соответствует 40,08/2=20,04 мг/л Са2+ или 24,3/2=12,15 мг/л Mg2+.
Различают общую, карбонатную, временную и постоянную и некарбонатную жесткость.
Общей жесткостью называется суммарная концентрация ионов Са2+, Mg2+ или солей кальция, магния.
Временной жесткостью называется часть общей жесткости, удаляющаяся кипячением воды при атмосферном давлении Она равна разности между общей и постоянной жесткостью. Обусловлена наличием в воде гидрокарбонатов калия и магния, которые при кипячении разлагаются:
Ca(HCO3)2 = CaС03 + СO2 + Н2O Mg(HCO3)2 = Mg(OH)2 + 2СО2
Постоянной жесткостью называется часть общей жесткости, остающаяся после кипячения воды при атмосферном давлении. Она обусловлена наличием кальциевых и магниевых солей серной, соляной, азотной, фосфорной и кремниевой кислот, которые при кипячении воды остаются в растворе.
Карбонатной жесткостью называется часть общей жесткости, эквивалентная концентрации карбонатов и гидрокарбонатов кальция и магния.
Некарбонатной жесткостью называется часть общей жесткости, она равна разности между общей и карбонатной жесткостью.
По жесткости воду разделяют на: очень мягкую (0-1,5мг-экв/л солей), мягкую (1,5-3), средней жесткости (6-10) и очень жесткую (свыше 10).