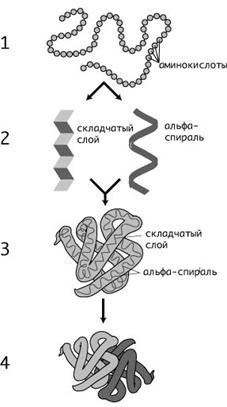
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
В настоящее время получены бесспорные доказательства, что в стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи. К этим связям относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия и т.д.
Четвертичная структура белка
Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных нековалентными связями (аналогичными тем, которые обеспечивают стабильность третичной структуры).
Классификация белков. Простые и сложные белки
По химическому строению белки разделяются на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот, а сложные при гидролизе распадаются на аминокислоты и различные вещества небелкового характера. Однако следует заметить, что такое разделение белков условно. Например, простые белки – альбумины, глобулины и некоторые другие могут содержать углеводный или липидный компоненты.К сложным белкам относятся преимущественно такие, у которых небелковая частица в значительной мере определяет характер структуры и биологическое действие белка, например гем в гемоглобине или нуклеиновая кислота в составе протеида.
ПРОСТЫЕ БЕЛКИ
К группе простых белков относят альбумины, глобулины, гистоны, протамины, протеиноиды, глютелины и проламины.
Альбумины - наиболее распространенная группа белков, они встречаются во всех тканях животных и растений, хорошо растворимы в воде и ненасыщенных солевых растворах. Альбумины -высокодисперсные и гидрофильные белки, что обеспечивает стойкость коллоидных растворов этих веществ. В зависимости от происхождения их называют сероальбумины (сыворотки крови), лактоальбумины (молоко), овоальбумины(яичные белки) и др. Альбумины характеризуются высоким содержанием аминокислоты лейцина (до 15 %) и очень низким количеством глицина. Молекулярная масса альбуминов колеблется от 35 000 до 70 000, а изоэлектрическая точка лежит при рН=4,6-4,7. Многие из альбуминов получены в кристаллическом виде (бычий сывороточный альбумин, яичный альбумин и др.).
Глобулины — наиболее многочисленная группа белков в организме животных (известно более двадцати индивидуальных глобулинов в сыворотке крови). Они нерастворимы в воде, но хорошо растворяются в разбавленных солевых растворах и щелочах. Это крупнодисперсные белки, они меньше гидратированы именее устойчивы в виде коллоидов по сравнению с альбуминами.
Гистоны — группа ядерных белков, в состав молекул которых входит от 20 до 30% диаминомонокарбоновых кислот (лизин, аргинин) и циклической аминокислоты — гистидина. Это белки со щелочными свойствами, так как из двух аминогрупп диаминомонокарбоновых кислот при построении белковой молекулы только одна (альфа-аминогруппа) используется для образования пептидной связи.
Протамины— белки, отличающиеся высоким содержанием диаминомонокарбоновых кислот (от 50 до 80 %), молекулярная масса их не превышает 10000. В протаминах содержится наибольшее количество аргинина и 6—8 других аминокислот, т. е. это простейшие белки.
СЛОЖНЫЕ БЕЛКИ
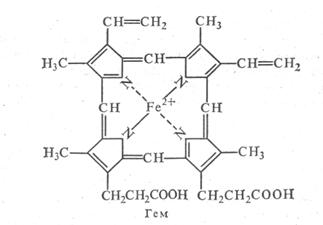
МЕТАЛЛОПРОТЕИДЫ
ФОСФОПРОТЕИДЫ. Построены из простого белка и остатков фосфорной кислоты, которые присоединяются при помощи сложноэфирной связи к гидроксильным группам аминокислот серина и треонина. Фосфорная кислота в молекуле фосфопротеида может образовывать не только моноэфирные связи, но также диэфирные и пирофосфорные. Считают, что последние два типа сложноэфирных связей способствуют скреплению полипептидных цепочек в макромолекулу белка,
Типичный представитель фосфопротеидов— казеиноген молока, состоящий из трех фракций: α-, β- и γ-казеина. Эти фракции отличаются содержанием фосфорной кислоты в пределах 0,1— 1 и 1,5 % соответственно.
Овоальбумин - фосфопротеид белковой части яйца, на долю которого приходится около 70% от всего яичного белка. К фосфопротеидам принадлежат белки яичного желтка- вителлин, вителлинин и витин, белок икры рыбы – ихтулин, а также ферменты – пепсин, фосфорилаза, фосфоглюкомутаза, фосфотриозоизомераза и др
Фосфопротеиды, являясь поставщиком аминокислот и кальция, в больших количествах входят в состав тех тканей, которые характеризуются большой интенсивностью обменных процессов (молоко, яичный белок, ихтулин икры рыбы).
ГЛИКОПРОТЕИДЫ. Это группа сложных белков, которые построены из простого белка и небелковой части, состоящей из углеводов, производных углеводов (гексуроновыекислоты), серной и уксусной кислот. Эти вещества встречаются в различных комбинациях в составе ряда гликопротеидов и освобождаются при гидролизе последних.
Различают истинные гликопротеиды, в составе которых имеются в небольшом количестве аминосахара (0,5-4,5 %), отсутствуют гексуроновые кислоты и сульфаты, и мукопротеиды, которые характеризуются высоким содержанием аминосахаров, гексуроновых кислот и сульфатов. Первые называются нейтральными глюкопротеидами, вторые — кислыми.
К нейтральным гликопротеидам можно отнести альбумины, глобулины и фибриноген плазмы крови, которые представляют собой непрочные комплексы белков с углеводными компонентами.
К кислым гликопротеидам относят муцины и мукоиды. Муцины составляют основу разных слизей организма (слюны, желудочного и кишечного сока) и выполняют защитную роль — ослабляют или исключают механическое и химическое раздражение слизистой оболочки пищеварительного тракта частицами корма и примесями.
ЛИПОПРОТЕИДЫ. Липопротеиды представляют собой различные комплексы простых белков с глицеридами, фосфолипидами и стеридами. Такие комплексы обнаружены во всех тканях и органах, а также в молоке и яйцах.