Основные положения теории детонации Михельсона
I II III IV V
1 dx 2
D D 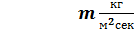
F
W1 W2

Изображена труба большой длины, заполненная газом. F – площадь поперечного сечения трубы (м2); dx – бесконечно малое расстояние между сечением трубы 1 и 2; V1–удельный объем м3/кг; P1 – давление (Па); T1– абсолютная температура (К); D- скорость детонации м/с; W – скорость диффузии м/с. Если в сечении 1 температуру повысить до воспламенения, то тепло путем теплопроводности будет передаваться ко 2 слою, а масса вещества путем диффузии будет перемещаться сюда же в обратном направлении из 3 секции. Если горение возникает во 2 слое, тепло передается к 3 слою и т.д., так происходит процесс нормального горения.
Если в сечении 1 ввести искру большой мощности, то возможно взрывное воспламенение с мгновенным повышением давления. За это мгновение 3 слой не успевает изменить свое положение, поэтому 2 слой оказывается сжатым с 2-ух сторон и там возникает мгновенное воспламенение. Такое явление происходит от слоя к слою. Последовательное сжатие слоев, называется волной сжатия. Волна сжатия, которая сопровождается воспламенением, называется детонацией.
Нормальная скорость горения изменяется от 0,5 до 2 м/с, а скорость детонации от 1000 до 3500 м/с.
Скорость детонации зависит от концентрации вещества.
Кривая скорости детонации водорода.
Д,м/c
1700
H,%
20 80
Исходные данные теории Михельсона
1) Сплошность или неразрывность потока:
G1=G2=m∙F;
m=(Д-W1)∙P1;
G1=W1∙P1=(Д1-W1)∙F∙  =m∙F;
=m∙F;
Д-W1=m∙V1 (1) или Д=W1+m∙V1;
Скорость детонации намного превышает скорость диффузии, поэтому:
Д=V1∙m (2)
Д-W2=m∙V2 (3)
Вычитаем из (1) уравнения (3) и получаем:
W2-W1=m∙(V1-V2) (4)
2) Закон импульсов:
P2-P1=m∙(W2-W1) (5)
Подставим 4) уравнение в (5) и получим (6):
P2-P1=m2∙(V1-V2) (6)
m= 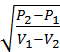 ;
;
Связь давления и удельного объема сжатия при известной скорости детонации:
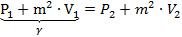 (8)
(8)
Из (8) получаем:
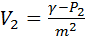 (I)
(I)
Из (2) находим:
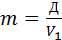 (II)
(II)
В процессе детонации изменяются все рабочие параметры (V,P,t).
В технической термодинамике этот процесс называют политропным. Для этого процесса дается уравнение энтропии, которое связывает все эти три параметра:
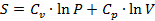 (9)
(9)
Cv- теплоемкость при постоянном объеме;
Сp- теплоемкость при постоянном давлении;
Sможно найти следующим образом:
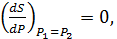 P=P2 (10)
P=P2 (10)
 ;
;
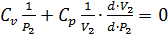 ;
;
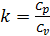 ;
;
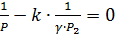 ,
, 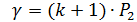 ;
;
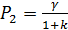 (III)
(III)
(III)→ (I)
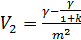 (IV)
(IV)
PV=RT(V)
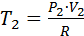 ;
;
При детонации сжатие опережает воспламенение.
Задача 1
Газ, с газовой постоянной R=287 Дж/кг∙К имеет начальные параметры до сжатия V1=0,751м3/кг, P1=105Па, К=1,4, Д=1425 м/c, Т1=272 К. Определить параметры сжатия V2, P2, T2.
Решение:
1) Определяем постоянную процесса детонации
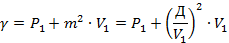
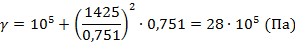
2) определяем давление сжатия по формуле
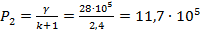 (Па)
(Па)
3)Определяем объем сжатия по формуле
 (м3/кг)
(м3/кг)
4) Определяем температуру воспламенения от сжатия

t=1800-273=1527 
5) Проверка на основе закона состояния термодинамики
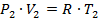 ;
;

524160 = 516600
Вывод: при детонации в заданных условиях, объем сжимается в 1,7 раз; давление возрастает в 11,7 раз; температура повышается в 6,6 раз.
Расчет температуры зажигания от раскаленных микротел.
При вбрасывании раскаленного тела шаровой формы в газовую среду в первый момент времени происходит теплоотдача с его поверхности по закону Ньютона
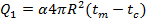 (Вт);
(Вт);
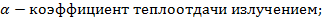
R- радиус шара;
tm-температура тела;
tc-температура газовой среды.
По истечении бесконечно малого отрезка времени, количество отдаваемого тепла находим по формуле:
 ;
;
dR – приращение радиуса в результате сгоревшей небольшой части газа.
 ;
;
 (I)
(I)
Поскольку dR2=0 как величина более высокого порядка малости.
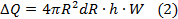
h-теплотворная способность газа;
W- скорость горения газа.
Минимальную температуру зажигания находим по формуле:
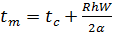 (3)
(3)
В любом случае должно выполняться условие tзаж>tтела (4)
Задача 2.
Определить минимальную температуру зажигания при условии tc= 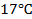 , R=0,0024м, h=40,4∙106Дж/кг,
, R=0,0024м, h=40,4∙106Дж/кг, 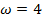 кг/с∙м3,
кг/с∙м3, 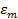 =0,8,
=0,8, 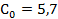 Вт/м2∙К.
Вт/м2∙К.
Так как тело раскаленное, то коэффициент теплоотдачи излучением
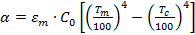 , но с учетом заданных условий
, но с учетом заданных условий
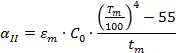
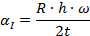
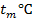
| ||||||
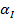
| ||||||
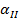
|
Решение:
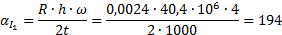

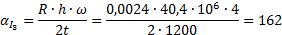
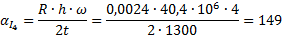
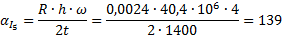


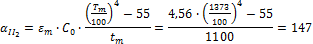


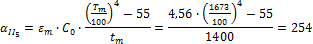
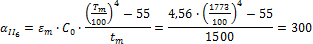

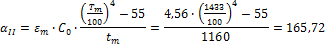
Вывод: 
Библиографический список:
Л.Н. Хитрин. Физика горения и взрыва. М: 1957 г. – 442 с.
В.М. Фокин. Г.П. Бойков, Ю.В. Видин. Основы технической теплофизики. М. Машиностроение -,2004г. – 170с.
Г.Н.Злотин, Е.Л. Федянов. Теплотехника. Волгоград, 2005 г., - 337 с.
В.П. Монахов. Методы исследования пожарной опасности веществ. М. Химия. 1972 г. – 414 с.