ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Выполнил студент: Киселев В.А
Группа: 3ТМб-01-11зп
Проверил преподаватель:
Пономарева И.В.
Оценка в баллах ____________________
2019/2020 уч. г.
Цель работы: получить теоретические сведения о химических источниках тока, практически ознакомиться с устройством и работой биметаллического гальванического элемента, сформировать навыки измерения и расчета электродвижущих сил гальванических элементов.
Приборы и реактивы: иономер, цинковая и медная пластины; химические стаканы вместимостью 100 см3, наждачная бумага, фильтровальная бумага, растворы ZnSO4 и CuSO4 с концентрациями: 0,1 М, 0,5 М, 1 М; солевой мостик, заполненный насыщенным раствором хлорида калия в смеси с агар-агаром.
Х о д р а б о т ы
1. Получить у преподавателя задание, в котором указаны виды металлов и значения концентраций растворов ZnSO4 и CuSO4 для измерения ЭДС трёх гальванических элементов (одна концентрация для CuSO4 и три концентрации для ZnSO4).
2. Пластинки металлов зачистить наждачной бумагой, промыть дистиллированной водой и просушить фильтровальной бумагой.
3. Пластину, изготовленную из меди присоединить к клемме «Всп.», а другую пластину присоединить к клемме «Изм.» иономера в режиме работы потенциометра.
4. В четыре стакана емкостью 100 см3 налить по 50 см3 растворов солей, укзанных преподавателем в задании.
5. В стакан с раствором ZnSO4 (с наименьшей концентрацией, если она варьируется) поместить пластинку соответствующего металла, в стакан с раствором CuSO4 (с наименьшей концентрацией, если она варьируется) поместить медную пластинку.
6. Включить прибор и замкнуть цепь, поместив в растворы солевой мостик.
7. Снять показания ЭДС с прибора, данные занести в табл. 1.
8. Меняя концентрацию раствора соответсвующей соли на большую, произвести измерения ЭДС для двух других растворов. Данные также занести в табл. 1.
Таблица 1.
Экспериментальные и расчетные данные
| № ГЭ | Концентрация ионов металла в растворе [Me2+], моль/дм3 | Теоретическое значение электродного потенциала
Е 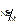 , В , В
| Значение ЭДС гальванического элемента Δ Е, В | П,% | ||||
| Теоретическое Δ Е теор, В | Экспериментальное Δ Е эксп, В | |||||||
| Zn2+ | Cu2+ | Е 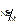
| Е 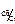
| |||||
| 0,1 | -0,79 | +0,34 | 1,13 | 1,166 | 3,1 | |||
| 0,5 | -0,769 | +0,34 | 1,109 | 1,167 | 5,2 | |||
| -0,76 | +0,34 | 1,1 | 1,170 | 6,3 |
Обработка экспериментальных данных
1. Запишите процессы, протекающие на электродах, токообразующую реакцию и схему изучаемого гальванического элемента.
CuSO4 + Zn = ZnSO4 + Сu
() Zn ZnSO4 CuSO4 Cu (+).
2. По уравнению (7) рассчитайте теоретические значения электродных потенциалов для всех концентраций, указанных преподавателем в задании.
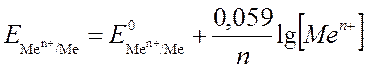 ,
,
3. Вычислите теоретические значения ЭДС для каждого случая по формуле (4).
Е = Е катод - Е анод.
4. Оцените относительную погрешность определения ЭДС для каждого опыта по формуле
П = 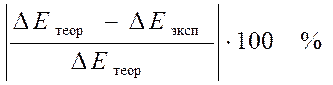 .
.
5. Результаты расчетов занесите в табл. 1.
6. Заполните метрологическую карту средств измерения (см. прил. 2) и сформулируйте выводы.
Метрологическая карта средств измерения
| № п/п | Наименование измерительного прибора | Пределы измерения | Диапазон показания шкалы прибора | Длина шкалы | Цена деления шкалы прибора | Чувствительность прибора | Класс точности прибора | Относительная погрешность прибора, % |
| Иономер | 0; 14 | 0–14 | 0,01 | 0,005 |
Вывод: мы получили теоретические сведения о химических источниках тока, практически ознакомились с устройством и работой биметаллического гальванического элемента, сформировали навыки измерения и расчета электродвижущих сил гальванических элементов.
Список литературы:
1. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой. – СПб.: «Иван Федоров», 2003. – 240 с.
2.Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие для студ. вузов. – 3-е изд., перераб. – М., 2007.


