Аминокислоты, белки.
Биологическое значение белков:
-структурная функция,
-катализ химических реакций
-участвуют в регуляции обменных процессов
-транспортная функция
-защитная функция
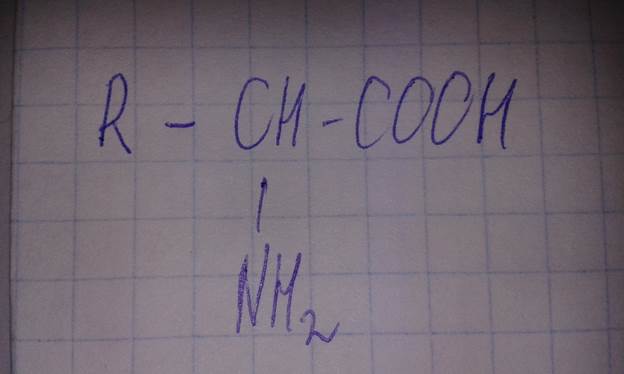
1010-1012 млн белков.
25 аминокислот
Аминокислоты.
-соединения, содержащие как минимум две функциональные группы
1) В составе белков живых организмов встречаются только 𝝰-аминокислоты
2) Все аминокислоты за исключением глицина содержат хиральные атомы углерода => характерно явление стереоизомерии, по конфигурации соединения относятся к L-стереохимическому ряду.
Аминокислоты отличаются по структуре радикала.
Классификация 𝝰 –аминокислот
Ациклические Циклические
Нейтральные Кислые Основные Ароматические Гетероциклические
Нейтральные (моноаминомонокарбоновые кислоты)
-гли
-ала
-вал
-лей
Кислые (моноаминодикарбоновые)
-асп
-глу
Основные (диаминомонокарбоновые)
-лиз
Ароматические
-тир
-фен
Гетероциклические
-гис
-три
-про
По способности синтезироваться в организме:
Заменимые (способны синтезироваться в организме) Незаменимые (не синтезируются)
Незаменимые аминокислоты:
-валин
-лейцин
-изолейцин
-триамин
-метионин
-триптофан
-фенилаланин
-лизин
Свойства:
В твердом состоянии и в водных растворах со значением рН от 4 до 10 аминокислоты присутствуют в виде биполярных ионов.
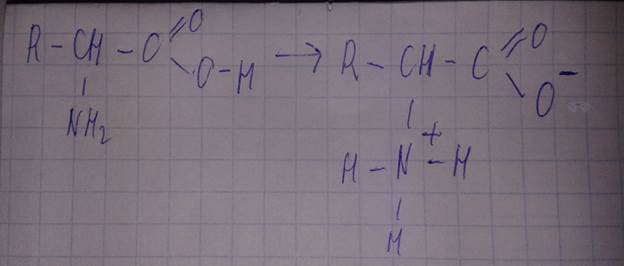
Биполярный ион
Если рН меньше 4, то будет подавляться диссоциация карбоксильной группы и соединение будет нести положительный заряд.
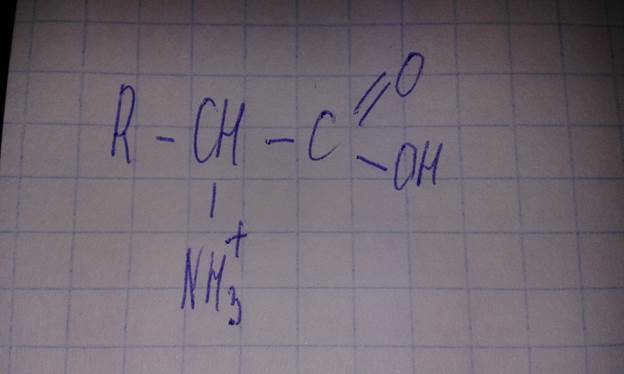
Катионная форма аминокислоты
Увеличение рН более 10 тормозит связывание протона аминогруппой, частица будет иметь отрицательный заряд.
|
|
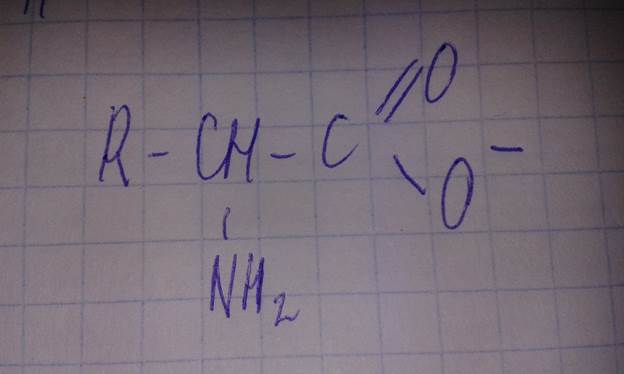
Анионная форма аминокислоты
Для каждой аминокислоты можно подобрать такое значение рН, при котором биполярный ион преобладает в равновесии, а концентрации катионных и анионных форм минимальны и равны друг другу. Это значение рН называется изоэлектрической точкой аминокислоты.
Вследствие того, что способность к ионизации (созданию заряда) у карбоксильной группы выше, чем у аминогруппы, изоэлектрическая точка нейтральных аминокислот находится при значении рН ≤ 7 (в слабокислой среде) – от 6.8 до 5.5
На ионизацию карбоксильной и аминогруппировок оказывают влияние и другие группировки, поэтому изоэлектрическая точка каждой аминокислоты индивидуальна.
Кислые аминокислоты.
У каждой кислой аминокислоты изоэлектрическая точка лежит в кислой среде, т.к. для подавления диссоциации второй карбоксильной группы требуется избыток протонов.
ИЭТ кислых аминокислот << 7 (сильнокислая среда).
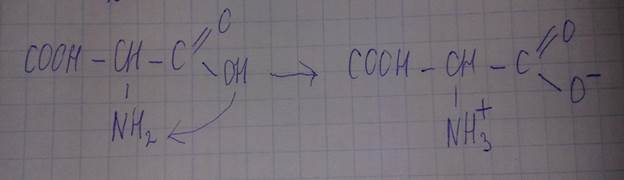
Основные аминокислоты
Изоэлектрическая точка лежит в щелочной среде, т.к. для подавления ионизации дополнительной аминогруппировки требуется избыток гидроксид-анионов.
Получение аминокислот.
-при гидролизе белков
-в лабораторных условиях
-в организме
1. Переаминирование (трансаминирование)

2. Восстановительное аминирование

Химические свойства аминокислот.
Обусловленные присутствием аминогруппировки.
-образование солей при взаимодействии с кислотами
-нуклеофильные свойства – реакции с альдегидами за счет электронной пары на атоме азота аминогруппировки
-удаление аминогруппировки – дезаминирование
|
|
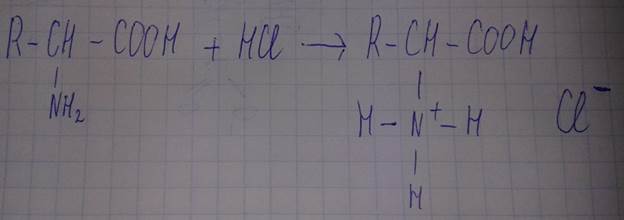
Реакция фармолового титрования. В результате реакции в реакционной смеси появляются протоны в количестве, эквивалентном (равном) содержанию аминокислоты. Содержание аминокислоты можно определить количественно путем титрования раствора щелочью.

Реакция дезаминирования in vitro в присутствии азотистой кислоты.

Реакция дезаминирования in vivo. Окислительное дезаминирование.
В присутствии ферментов – оксидаз.
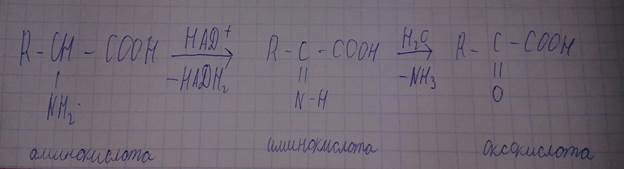
Реакция неокислительного дезаминирования.
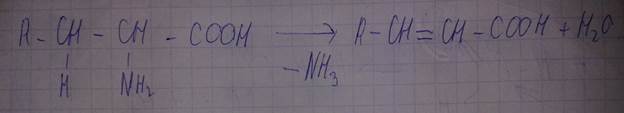
Количество выделившегося азота можно измерить и рассчитать количество аминокислоты, вступившей в реакцию.
Обусловленные присутствием карбоксильной группировки.
-образование солей.
-реакции замещения
-декарбоксилирование – удаление карбоксильной группировки
Реакция образования соли.
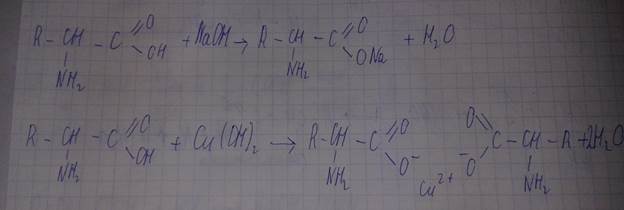
Реакция декарбоксилирования.
В организме в присутствии ферментов – декарбоксилаз.
В пробирке – при нагревании в присутствии гидроксида бария.
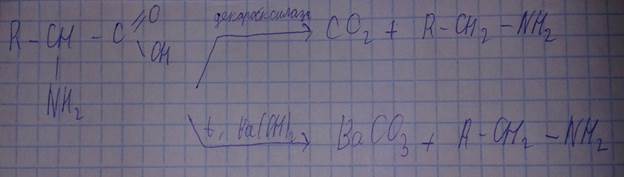
Реакция замещения.
Реакция взаимодействия двух аминокислот.
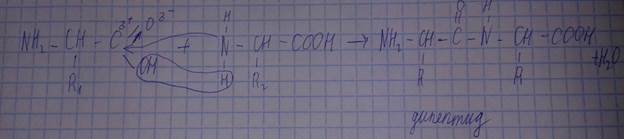
Образовался дипептид. Дипептид имеет в своей структуре свободные амино- и карбоксильную группы, следовательно, может реагировать с аминокислотами с образованием полипептида.
Признаки полипептидной цепи:
1. Начинается с N-конца (свободная концевая аминогруппировка).
2. Заканчивается С-концом.
3. Состоит из чередующихся 𝝰-атомов углерода и пептидных связей.
4. Радикалы аминокислот находятся на периферии.
5. Полипептидная цепь не ветвится (неразветвленное строение).
Полипептиды и белки – это полимерные соединения, мономерными единицами которых являются остатки аминокислот. Представляют собой полипептидную цепь.
|
|
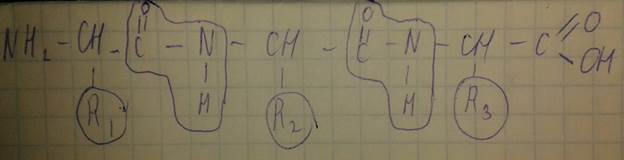
Различия в свойствах отдельных полипептидов и белков определяются не структурой остова полипептидной цепи, а набором имеющихся аминокислотных радикалов. Полипептидная цепь, содержащая менее 100 аминокислотных остатков образует полипептид, а более 100 – белок. Для каждого полипептида характерна присущая только ему последовательность соединения аминокислотных остатков. Эту уникальную последовательность принято называть первичной структурой белка.
Стабилизация первичной структуры осуществляется за счет ковалентных пептидных связей между аминокислотными остатками. Происходит уменьшение длины пептидной связи, значительное ограничение возможности вращения вокруг оси пептидной связи, в результате пептидная связь приобретает жесткую плоскую пространственную структуру. Полипептидная цепь не растянута в пространстве в виде прямой, а уложена образованием структуры, напоминающей винтовую лестницу (𝝰-спираль). Спираль имеет правую закрутку. Боковые радикалы аминокислот находятся на периферии, на один виток спирали приходится 3,6 аминокислотных остатка. Длина одного витка – 0,54 нм. Спиральная структура стабилизируется за счет водородных связей, образованных между СО-группировкой каждого первого и NH-группировкой каждого пятого аминокислотного остатка, встречающихся на соседних витках спирали.
Еще один вариант пространственной структуры возникает в том случае, если две полипептидные цепи расположены параллельно друг другу. Цепи укладываются в виде складчатых листков и между несколькими полипептидными цепями образуются водородные связи (𝝱-структура) – стабилизируется водородными связями.
𝝱-структура получила название вторичной структуры белка. Дальнейшая пространственная упаковка в полипептидной цепи определяет внешнюю форму молекулы белка – его третичную структуру (III). III структура стабилизируется в результате взаимодействий между радикалами аминокислот.
Взаимодействия:
1. Водородные связи между радикалами полярных аминокислот.
2. Дисульфидные связи между остатками цистеина.
3. Ионные связи между заряженными радикалами основных аминокислот (аргинин, лизин) и ионизированными группировками кислых аминокислот (асп, глу).
4. Взаимодействие между радикалами алифатических аминокислот за счет сил Ван-дер-Ваальса – сил гидрофобного взаимодействия.