ПРАКТИЧЕСКАЯ РАБОТА № 8-17
ТЕМА: Методы сбора, фиксации и количественного учета фитопланктона.
Цель работы: изучить методы работы на водоемах по сбору и обработке фитопланктона.
Задание: 1. Изучить виды оборудования, используемого для сбора фитопланктона.
Задание: 2. Познакомиться с методами фиксации и концентрации проб фитопланктона.
Задание: 3. Записать в рабочую тетрадь последовательность действий при проведении качественного и количественного учета фитопланктона
Информация для ознакомления
К планктону относятся водные организмы растительного (фитопланктон) и животного (зоопланктон) происхождения, которые ведут свободно-плавающий или взвешенный в толще воды образ жизни. Для планктонных организмов характерно или полное отсутствие органов движения (многие представители фитопланктона), или они у них развиты слабо. Планктон имеет размеры от долей мм до нескольких мм и делится на следующие категории:
- мезопланктон — организмы, хорошо видимые простым глазом, размеры их измеряются несколькими миллиметрами;
- микропланктон — организмы микроскопические, не проходящие через отверстия самого плотного шелкового газа (№ 25/77); их размеры от 50 до 1000 нм;
- наннопланктон — организмы, свободно проходящие через отверстия самого плотного шелкового газа и потому не улавливаемые планктонными сетями; их размеры меньше 50 нм.
1. Сбор планктонных организмов.
Сбор планктона в большинстве случаев состоит из двух процессов:
а) взятия (зачерпывания) пробы воды, содержащей планктон и доставки ее на поверхность,
б) отделения (отцеживания) планктона от воды. Оба эти процесса могут осуществляться одновременно или отдельно в зависимости от конструкции используемой аппаратуры.
Отбор проб проводится с помощью различного оборудования. Выбор прибора зависит целей исследования (качественный или количественный учет), а также от размеров организмов и места их обитания (поверхностный слой, толща воды и дно водоема).
При отборе мелких форм фитопланктона из толщи воды используются батометры различных конструкций. Наиболее распространенные – батометр Рутнера и сосуд Мейера (рис. 1).
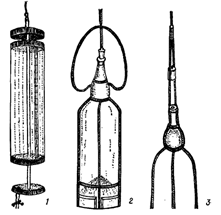
Рисунок 1. Приборы для сбора количественных проб фитопланктона: 1 – батометр Рутнера; 2, 3 – сосуд Мейера (опускается в воду в закрытом виде – 2; при достижении определенной глубины открывается рывком за трос, прикрепленный к пробке, и после заполнения его водой поднимается в открытом состоянии – 3).
Батометр опускают в воду и при достижении необходимой глубины сильным встряхиванием троса (или же посредством специального «посыльного груза») закрывают крышки отверстий одного или двух цилиндров (в зависимости от конструкции батометров). Затем батометр в закрытом виде извлекают на поверхность. При изучении фитопланктона поверхностных слоев водоема пробы отбирают, зачерпывая воду в сосуд определенного объема.
Для работы на пресных водоемах чаще всего используются 1–2-литровые батометры, а в морях – 2- и 5-литровые. В водоемах, бедных фитопланктоном, отбирают пробы объемом не менее 1 л. В водоемах, богатых фитопланктоном – 0,5 л, а при «цветении» воды – даже 0,25 л. Отбор проб батометрами позволяет отбирать водоросли всех размерных групп, как для качественного, так и для количественного учетов.
Для обнаружения малочисленных видов фитопланктона используют планктонную сеть. Такая сеть состоит из металлического кольца и пришитого к нему мешка конической формы из мельничного шелкового или капронового сита № 77 (рис. 2, А). Внизу сеть заканчивается стаканчиком, в который собирается планктон при фильтрации воды через сеть.
Для количественного учета водорослей планктонная сеть непригодна. При сетном сборе фитопланктона в планктонную сеть попадают только колонии и крупные клетки водорослей, тогда как клетки небольших размеров «проскакивают» через фильтрационную поверхность сита. Поэтому обловы фитопланктона сетью должны сочетаться с пробами, собранными с помощью батометра.
А Б
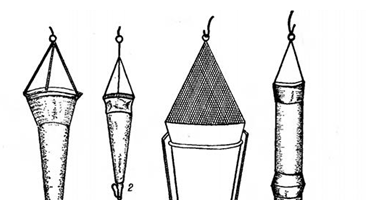
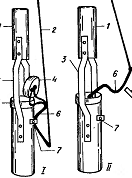
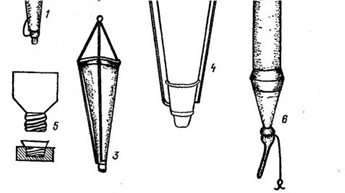
Рисунок 2. А. Планктонные сети: 1–3 – сеть Апштейна; 4 – сеть Берджи; 5 – стаканчик к ней; 6 – цилиндрическая сеть «цепеллин».
Б - Микробентометры Владимировой в открытом (I) и закрытом (II) виде: 1 – железная трубка, соединяющаяся с разборной штангой; 2 – шнур; 3 – кронштейн; 4 – крышка-клапан; 5 – втулка с конусом; 6 – рычаг; 7 – зажим-пружина.
Существующие методы отбора проб фитобентоса предусматривают сбор водорослей, обитающих на поверхности донных грунтов и отложений, в их толще (глубиной до 1 см) и придонном слое воды толщиной 2–3 см. Для изучения видового состава фитобентоса достаточно извлечь на поверхность некоторое количество донного грунта и отложений на нем.
На мелководьях (глубиной до 0,5–1 м) это достигается с помощью опущенной на дно пробирки или сифона – резинового шланга со стеклянными трубками на концах, в который засасывают ил.
На больших глубинах количественные пробы отбирают с помощью ведерка или стакана, прикрепленного к шесту, а также различными дночерпателями.
Для отбора количественных проб фитобентоса используют микробентометр Владимировой (рис. 2, Б). Основная его часть представляет собой латунную трубку длиной 25–30 см с внутренним диаметром 4–5 см. На верхнем конце этой трубки находится втулка с конусообразной воронкой, в которую на рычаг герметически входит притертая крышка-клапан. Трубку с отрытой крышкой на деревянной штанге опускают на дно и врезают заточенным нижним концом в толщу грунта на несколько сантиметров. Потянув за веревку, закрепленную на свободном конце рычага, закрывают верхнюю втулку трубки крышкой, после чего прибор осторожно извлекают на поверхность.
При выходе трубки из воды нижнее отверстие трубки закрывают ладонью, чтобы не допустить выпадение грунта. Открыв крышку, осторожно сливают верхние слои воды в стеклянную посуду до появления мути (в дальнейшем эту часть воды выливают). Оставшуюся в трубке воду, ил и грунт легко встряхивают и переносят в приготовленную посуду, предварительно измерив ее объем. Микробентометр Владимировой удобен при работе на глубинах до 2–2,5 м.
2. Методы обработки планктона.
При обработке планктона используются методы качественного и количественного учета. Обработка проб может проводиться как с живыми, так и с фиксированными организмами.
При работе с живыми организмами обработку проб необходимо проводить или непосредственно после вылова, или как можно быстрее в специально оборудованном пункте в экспедиционном лагере. Лучшее сохранение проб обеспечивается при более низкой температуре и доступе воздуха в емкости с планктонными организмами.
При качественном учете живых организмов в первую очередь следует определять те виды планктона, которые сложно определить после фиксации или отмирании, прежде всего наиболее мелкие формы: простейшие и беспанцирные коловратки. Эти организмы достаточно сложно заметить в увеличительные приборы, так как они прозрачные и быстро передвигаются в поле зрения. Для снижения их активности применяются различные вещества, обладающие наркотическими свойствами (хлоралгидрат, хлороформ) или вещества, повышающие вязкость воды. Например, прибавление вишневого клея или нагревание капли значительно замедляет движение.
Так как консервирование организмов сильно деформирует некоторых из них, то при обработке их в живом виде выигрывается точность определения. Однако, в большинстве случаев при обработке проб фитопланктона требуется их предварительная концентрация и фиксация.
Численность большинства водорослей, за исключением отдельных видов во время «цветения», очень низка. Поэтому их практически невозможно учесть без предварительного концентрирования.
Существует несколько методов концентрирования:
а) Осадочный метод концентрации проб (пробы отстаиваются 10 суток, а затем фильтрат очень медленно отсасывается сифоном через двойной слой газа № 76). Уплотнение пробы проводится в два этапа: от 0,5 до 0,1 л, затем после вторичного отстаивания (можно не более 5 суток) раствор отсасывается вновь. Бедные пробы (например, зимние) доводятся до объема 10 мл, а чаще до 20 мл, очень богатые (например, в период «цветения» сине-зеленых) – до 50–100 мл (в этом случае вторичное отстаивание не производится).
б) Метод фильтрации проб через мембранные фильтры пригоден для концентрирования живых и фиксированных водорослей. Объем фильтруемой пробы зависит от двух условий: от концентрации водорослей и плотности фильтра. Чаще всего для фильтрации используют мембранные фильтры с порами 1,5 и 2,5 мкм, а если размеры водорослей очень малы, то – 0,2–0,6 мкм.
в) Метод центрифугирования применяется для концентрирования густых проб живого фитопланктона или при работе с культурами водорослей. В таком сконцентрированном материале возможен учет жгутиковых и других мелких и подвижных водорослей. Центрифугируется 20–50 мл пробы в течение 20–30 мин. при 1000–2000 об/мин. Супернатант осторожно удаляют сифоном, оставляя 1/10–1/50 часть первоначального объема. Осадок ресуспензируют круговым помешиванием в оставшемся объеме воды и просматривают в счетной камере.
Для концентрирования и предохранения фитопланктона от разрушения при длительном хранении используются разнообразные химические соединения и их смеси. Консервацию осуществляют сразу же после отбора проб добавлением к ним фиксирующего реагента.
Методы консервации:
а) Формалин. Используют 2%-й раствор формалина (зимой) или 4%-й (летом) раствор. К пробе добавляется 40% раствор формалина в таком количестве, чтобы получилась требуемая концентрация во всем объеме пробы. Большие концентрации указанного фиксатора вызывают деформацию водорослей и изменение цвета их пигмента.
б) Раствор Люголя является хорошим фиксатором, и его используют, если количественная обработка проб осуществляется не позже трех месяцев с момента фиксации проб. Для приготовления раствора Люголя используют 15 г KI, который растворяют в 50 мл дистиллированной воды, добавляют 10 г кристаллического йода и доводят раствор дистиллированной водой до общего объема 500 мл. Расход фиксатора составляет 2 мл на 100 мл пробы. Фиксированные пробы необходимо хранить в темноте.
При его употреблении в пробах хорошо сохраняются нежные формы фитопланктона. Кроме того, использование этого фиксатора позволяет обнаруживать пиреноиды, жгутики, слизь и чехлы вокруг клеток.
Каждая проба снабжается этикеткой. Этикетку надо четко писать на узкой полоске бумаги или пергамента и вкладывать внутрь банки. В пробах с осадочным планктоном следует прищемить чистый конец этикетки пробкой. Запись на этикетке такая:
· № пробы
· № станции,
· дата,
· название водоема,
· место сбора,
· глубина,
· орудие лова
· продолжительность лова,
· подпись.
Очередной номер надо повторить на пробке чернильным карандашом. Этикетки, написанные карандашом, при первой же возможности, заменяются постоянными, написанными несмывающейся тушью. Необходимо вести журнальную запись проб, куда записывать все, что потребуется при обработке проб и оформлении работы: состояние погоды, данные по прозрачности, цветности воды, глубине водоема, скорости течения, химизму воды, характеру лова, продолжительности работы, объему профильтрованной через сетку воды и пр.
Нумерация должна быть отдельной для проб, собранных разными методами. Пробы хранятся в порядке номеров в защищенном от света месте. Пробы заливаются парафином или смесью воска и парафина, причем перед заливкой, в случае необходимости пересылки проб, они доливаются до пробки профильтрованной водой. Пробы при пересылке, чтобы они не могли разбиться, тщательно укладываются в прочный ящик со стружками или войлоком.
Исследование планктона в консервированном виде производится следующим образом. Часть осадка берется пипеткой из сосуда, переносится на предметное стекло, накрывается покровным стеклом и исследуется под микроскопом или бинокуляром. Пипетка для взятия капли не должна быть слишком узкой. Для устранения или ослабления недостатка, связанного с деформацией некоторых организмов от фиксации, рекомендуется, насколько возможно чаще, предварительно или параллельно просматривать живой материал на месте взятия пробы или в лаборатории и делать соответствующие пометки, зарисовки, касающиеся морфологии отдельных форм, чтобы иметь надежные отправные пункты в случае сомнений, которые могут возникнуть при определении в консервированном виде.
Для количественного учета организмов используются различные методы. Самым простым способом определения частоты встречаемости отдельных форм организмов является пяти-шестибалльная шкала:
1. Организмы встречаются не в каждом препарате. Обозначается дробью, числитель которой показывает количество найденных экземпляров, а знаменатель число препаратов.
2. В каждом препарате обнаружено не более 10 экземпляров — обозначается цифрой 1.
3. В каждом препарате в количестве 10 экземпляров, но не в каждом поле зрения — цифрой 2.
4. Н каждом поле зрения в количестве от 1 до нескольких экземпляров — цифрой 3.
5. В массе — знаком ∞
6. Если в препарате организмов 2—3, то при преобладающем из них после ∞ ставится восклицательный знак (!).
Другой способ количественного учета фитопланктона является определение его численности в объеме воды с предварительным подсчетом экземпляров в счетных камерах. Например, просчет численности организмов на 1 л воды проводят по следующей формуле:
N = k * n * (A/a) * v * (1000 / V), где
N – количество организмов в литре воды исследуемого водоема;
k – коэффициент, показывающий во сколько раз объем счетной камеры меньше 1 см3;
n – количество организмов, обнаруженных на просмотренных дорожках (квадратах);
A – количество дорожек (квадратов) в счетной камере;
a – количество дорожек, на которых производился подсчет водорослей;
v – объем концентрата пробы (см3);
V – первоначальный объем отобранной пробы (см3).
Вопросы для самоконтроля:
1. Какие организмы относят к планктонным?
2. Какие формы фитопланктона выделяют, в зависимости от размера организмов?
3. Какое оборудование используется для сбора фитопланктона?
4. В каком случае используются батометры, а в каком планктонные сети при сборе фитопланктона?
5. Назовите методы фиксирования проб фитопланктона.
6. Назовите методы концентрирования фитопланктона. С какой целью их проводят?
7. Какие методы количественного учета фитопланктона вы знаете?
8. Для чего проводится этикетирование проб и какие существуют требования к оформлению этикетки?
9. Почему исследование некоторых видов фитопланктона необходимо проводить без консервирования проб?