Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное
Учреждение высшего профессионального образования
Рыбинский государственный авиационный технический
Университет имени П. А. Соловьева
Кафедра авиационных двигателей
Типовой расчет
Вариант 3
Студент гр. ЭПБ-12 Сафонов И. О.
Преподаватель Лебедев В. В.
Дата защиты
Подпись
Рыбинск, 2013
Задача 1. Расчет газовой смеси
Газовая смесь состоит из нескольких компонентов, содержание которых в смеси задано в процентах по объему.
Определить: 1) кажущуюся молекулярную массу смеси; 2) газовую постоянную смеси; 3) средние мольную, объемную и массовую теплоемкости смеси при постоянном давлении в пределах температур от t1 до t2.
Дано:
CO2=14%
O2=3%
N2=83%
t1=592 C°
t2=1492 C°
Решение:
1. Вычислим кажущуюся молекулярную массу смеси:
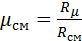 (1)
(1)
Эта формула недостаточно удобная, так как нам не дана газовая постоянная смеси, поэтому мы воспользуемся другой.
Запишем уравнение состояния для массы газа mi:
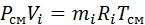 или, с учетом
или, с учетом 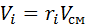
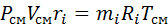
Заменим 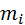 и
и 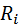 на:
на:
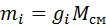 ,
, 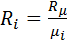
Получим:
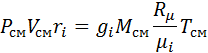
Если записать выражения для каждого компонента смеси и просуммировать, то получим:
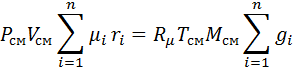
с учетом того, что:
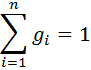
тогда
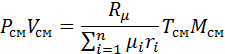
Таким образом
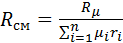 (2)
(2)
Выполнив подстановку в формулу 1, получим, что 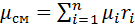
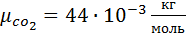 ,
, 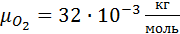
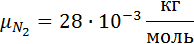
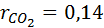
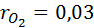
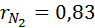
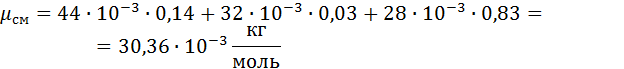
2. Вычислим газовую постоянную смеси.
Для этого воспользуемся формулой (2), выведенной в предыдущем пункте:
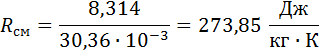
3. Вычислим средние мольную, объемную и массовую теплоемкости смеси при постоянном давлении в интервале температур от 592С° до 1492С°.
Определим по таблице средние мольные теплоемкости при p=constдля компонентов смеси для верхнего и нижнего предела температур:
Для t1=592C°:
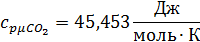
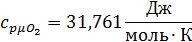
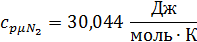
Для t2=1492C°:
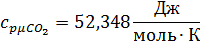
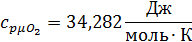
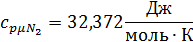
Воспользуемся формулой для определения средней мольной теплоемкости смеси в интервале температур:
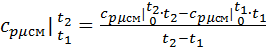 , где
, где 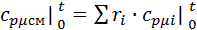
Найдем средние мольные теплоемкости смеси для t1и t2:
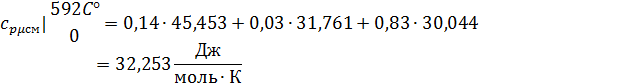
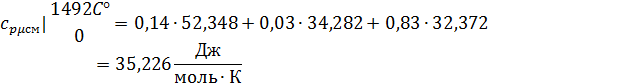
Подставим значения в формулу:
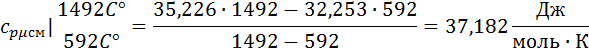
Зная среднюю мольную теплоемкость смеси несложно получить средние объёмную и массовую теплоемкости по известным зависимостям:
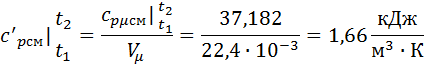
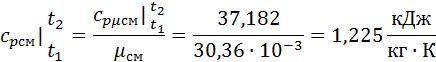
Вопросы:
1.Что называется удельной газовой постоянной? Единица ее измерения в системе СИ. Чем она отличается от универсальной газовой постоянной?
Удельной газовой постоянной называется величина, численно равная работе расширения одногомоля идеального газавизобарном процессепри увеличении температуры на 1К.
Универсальная газовая постоянная связывает объем, давление и температуру для одного моля любого вещества. Дж/(моль*К)
Удельная газовая постоянная связывает те же величины для единицы массы конкретного вещества. Дж/(кг*К).
2. Что представляют собой массовая, объемная и мольная теплоемкости? Каковы единицы их измерения в системе СИ? Какова связь между указанными теплоемкостями?
Массовая теплоемкость – теплоёмкость, отнесенная к единице массы рабочего тела. Единицей измерения массовой теплоемкости является Дж/(кг*К)
Объёмная теплоемкость – теплоёмкость, отнесенная к единице объёма рабочего тела. Единицей измерения массовой теплоемкости является Дж/(м3*К)
Мольная теплоемкость – теплоёмкость, отнесенная к к количеству рабочего тела(газа) в молях. Единицей измерения массовой теплоемкости является Дж/(моль*К)
3. Какие факторы влияют на величину теплоемкости.
Термодинамический процесс, при котором происходит теплопередача.
Молярная масса газа.