Практикум по физической химии
методические указания
Лабораторная работа «Определение скорости реакции омыления этилуксусного эфира»
Химическая кинетика
Москва 2020
Оглавление.
1. Химическая кинетика. 3
1.1. Краткая теория. 3
1.2. Лабораторная работа 9. Определение скорости реакции омыления этилуксусного эфира. 7
Химическая кинетика
Краткая теория
Скорость гомогенной химической реакции определяется изменением количества какого-либо вещества в единице объема за единицу времени. Изменение количества данного вещества в системе за единицу времени можно выразить производной dn/dt, где n – число молей вещества, а t – время. Обозначим через V – объем системы, тогда мгновенная (истинная) скорость реакции выразится соотношением:
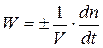 (1.1)
(1.1)
Это выражение используют со знаком плюс, если скорость определяется по образующемуся в реакции веществу, а со знаком минус, если скорость реакции определяется по расходующемуся в реакции веществу. Таким образом, скорость реакции всегда положительна. Для реакции, проходящей в системе постоянного объема, выражение скорости примет вид:
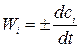 (1.2)
(1.2)
где сi – концентрация i -го вещества, Wi – скорость реакции по i ‑му веществу.
Если в системе протекает реакция с участием нескольких веществ, например:
n1A + n2B + n3D + … Þ n1¢M + n2¢N + n3¢L …,
то для однозначного определения скорости реакции достаточно следить за концентрацией какого-либо одного вещества. Изменение концентрации других участников реакции можно найти по соотношениям их стехиометрических коэффициентов
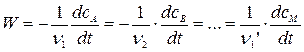 (1.3)
(1.3)
Скорость реакции зависит от концентрации, природы реагирующих веществ, температуры, среды, в которой протекает реакция, от присутствия катализатора и его концентрации.
Зависимость скорости реакции от концентрации выражается основным законом кинетики: скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. Для реакции приведенной выше, основной закон кинетики запишется в виде:
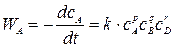 (1.4)
(1.4)
где k – константа скорости реакции. Константа скорости не зависит от концентрации, различна для разных реакций и сильно зависит от температуры. Физический смысл константы скорости легко найти, если сA=сB=сD =1, то
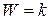 , (1.5)
, (1.5)
то есть k – это скорость реакции при концентрации реагирующих веществ равных 1. Поэтому ее называют удельной скоростью реакции.
Сумма всех показателей степеней при концентрациях в выражении основного закона – это общий кинетический порядок реакции (n):
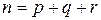 (1.6)
(1.6)
Какой либо показатель степени, взятый в отдельности (p, q, r), называется порядком реакции по данному веществу. При изучении кинетики, реакции обычно классифицируют по признаку кинетического порядка:
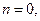
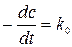 (нулевой порядок)
(нулевой порядок)
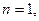
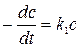 (первый порядок)
(первый порядок)
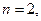
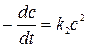 (второй порядок)
(второй порядок)
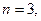
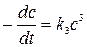 (третий порядок)
(третий порядок)
С общим кинетическим порядком выше третьего практически встречаться не приходится. На практике часто порядок реакции бывает дробным, что объясняется сложным механизмом протекания реакции. Порядок реакции выражает лишь зависимость скорости реакции от концентрации реагирующих веществ, и не дает ни каких указаний об истинном механизме реакции. Механизм реакции может быть чрезвычайно сложным, а сама реакция многоступенчатой. Каждый элементарный акт сложной реакции можно характеризовать понятием молекулярность. Это число молекул, участвующих в одном элементарном акте взаимодействия. Молекулярность и порядок реакции совпадают в редких случаях – только для простейших реакций или когда одна из стадий, молекулярность которой совпадает с числом молекул участвующих в реакции по уравнению реакции, является лимитирующей, т.е. определяет скорость всего процесса в целом.
Установлено, что в ряде случаев по кинетическому уравнению мономолекулярной реакции протекают реакции, по существу не являющиеся мономолекулярными. Такие реакции называются псевдомономолекулярными. В качестве примера такой реакции рассмотрим реакцию инверсии тростникового сахара. Она протекает по уравнению:
C12H22O11 + H2O = C6H12O6 + C6H12O6
Глюкоза Фруктоза
Данная реакция катализируется ионами водорода. Элементарным актом химической реакции является взаимодействие молекулы сахара с молекулой воды, то есть по существу реакция бимолекулярна. По закону действия масс скорость этой реакции определяется уравнением:
W=kCсахCH2O.
Однако ввиду того, что в разбавленном растворе концентрация воды практически постоянна, данное уравнение можно переписать:
W=k/Cсах,
где k/=kCH2O.
Тогда 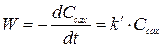 ; интегрируя это уравнение, получим:
; интегрируя это уравнение, получим:
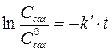 ,
,
где 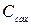 и
и 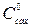 - текущая и начальная концентрации сахара.
- текущая и начальная концентрации сахара.
Примером реакции, описывающейся кинетическим уравнением второго порядка, является процесс омыления уксусноэтилового эфира (этилацетата).
CH3COOC2H5 + NaOH «CH3COONa + C2H5OH
Данная реакция протекает практически до конца, поэтому может считаться односторонней. Скорость ее пропорциональна концентрации эфира и щелочи, и определяется уравнением:
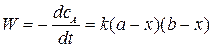 (1.7)
(1.7)
где a – начальная концентрация щелочи, b – начальная концентрация эфира, х – количество щелочи и эфира, израсходованных к моменту времени t, (a – x) – концентрация щелочи в данный момент времени, (b – x) – концентрация эфира в данный момент времени.
В интегральной форме уравнение примет вид:
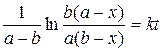 (1.8)
(1.8)
Лабораторная работа 9. Определение скорости реакции омыления этилуксусного эфира.
Цель работы – Определение константы скорости реакции омыления этилуксусного эфира.
Аппаратура. Измерение скорости реакции сводится к определению зависимости концентрации вещества участвующего в реакции от времени. Применяемые в кинетике для этой цели методы условно можно разделить на химические и физические. Химические методы дают непосредственно абсолютные значения концентраций, но они менее удобны, т.к. связаны с отбором проб в различные моменты времени, необходимости «замораживания» процесса вследствие долгой аналитической процедуры и т.п. В физических методах анализа измеряется, какое либо физическое свойство реакционной смеси, непосредственно связанное с концентрациями реагирующих веществ и продуктов, изменяющееся в ходе реакции. К таким свойствам можно отнести: давление и объем – для газовых реакций; оптические свойства, электропроводность, вязкость, теплопроводность и др. Преимущество физических методов в их быстроте. Часто такие измерения производятся прямо в реакционном сосуде, так, что отпадает отбор проб и связанные с этой операцией ошибки. Обычно физические измерения никак не влияют на состояние системы. При этом часто можно применять непрерывную автоматическую запись изменения свойства системы. Однако физические методы не дают непосредственно абсолютных значений концентрации. Могут появиться ошибки связанные с переводом значения измеряемого свойства в концентрацию. Например, при спектроскопическом изучении малые количества сильноокрашенных загрязнений или побочных продуктов могут сильно исказить картину. Поэтому для детального изучения кинетики какой-либо реакции полезно применять несколько методов. Если реакция происходит с изменением числа или типа ионов и связана с изменением электрического сопротивления, то за ее ходом можно следить, измеряя электрическое сопротивление раствора.
Например, в ходе реакции омыления этилацетата раствором гидроксида натрия изменяется концентрация ионов ОН–. Так как подвижность иона ОН– значительно больше подвижности ацетат-иона, сопротивление реакционной смеси с течением времени увеличивается, а электропроводность уменьшается.
Удельная электропроводность реакционной смеси в начальный момент времени определяется электропроводностью щелочи и равна:
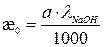 (1.9)
(1.9)
где а – начальная концентрация щелочи, а l – ее эквивалентная электропроводность. Так как l = lNa++lOH‑, то:
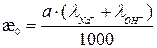 . (1.10)
. (1.10)
Зависимость эквивалентной электропроводности 0,05N раствора щелочи от температуры выражается уравнением:
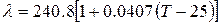 . (1.11)
. (1.11)
Подставив уравнение (1.11) в уравнение (1.10), и решив последнее относительно а, получим:
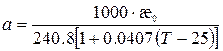 (1.12)
(1.12)
Удельная электропроводность в данный момент реакции равна:
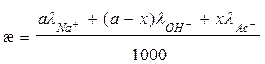 . (1.13)
. (1.13)
Из уравнений (1.9) и (1.13) следует, что:
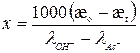 (1.14)
(1.14)
Считая, что разность (lOH‑ ‑ lAc-) неизменна в течение реакции и приблизительно равна 155 См/(см2*г-экв), получим:
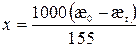 (1.15)
(1.15)
Так как начальная концентрация эфира b равна концентрации ионов Ac‑, образовавшихся к концу реакции, то из уравнения (1.14) следует, что:
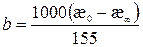 (1.16)
(1.16)
Определив на опыте æ0, æt, æ¥, по приведенным выше уравнениям (1.12), (1.15), (1.16) рассчитывают начальные концентрации щелочи и эфира, а также количество щелочи и эфира, израсходованные к моменту времени t и к моменту полного завершения реакции (t = ¥). Значение æ¥ получают путем измерения электропроводности раствора после проведения реакции в термостате при 80oС в течение 1 часа, с последующим охлаждением раствора.
Приборы и реактивы
1. Модули «Электрохимия» и «Универсальный контроллер» учебно-лабораторного комплекса «Химия»,
2. Мерная колба на 50 мл,
3. Пипетки на 25 мл,
4. Раствор NaOH ~ 0.01N,
5. Раствор HCl 0.01 N или H2SO4 0.01 N (фиксанал),
6. Раствор этилуксусного эфира 0.1 N,
7. Реакционный сосуд – колба на 100 мл,
8. Сосуд для определения электропроводности – химический стакан на 50 мл,
9. Бюретка на 25 мл,
10. Раствор KCl 0.01 N (фиксанал),
11. Водный раствор CH3COOC2H5 ~ 0,1N,
12. Индикатор метиловый красный.