Для выполнения первой части КР
Порядок расчета
1. Обработка исходных данных для газовой смеси.
1.1 Смесь состоит из пяти индивидуальных газов. Нужно для каждого газа записать молярную массу. Данные имеются в пособии на стр. 58. Можно принимать округленно. Например, для метана μ(СН4)=16 г/моль (в таблице 16,04 г/моль).
1.2 Определить объемные доли компонентов смеси. Для этого переводим объемную концентрацию из процентов в доли (делением на 100). Например, VСН4=80%, объемная доля - 0,8.
1.3 Определить молярную массу газовой смеси по формуле, г/моль
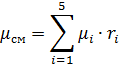
1.4 Газовая постоянная смеси рассчитывается по формуле, кДж/(кг∙°С)
Rсм =8,314/μсм
1.5 Массовые доли компонентов газовой смеси определятся для каждого из пяти газов
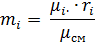
Сумма массовых долей должна быть равна единице.
1.6 Начальный объем газовой смеси

где Т1 абсолютная температура в градусах Кельвина.
1.7 Конечный объем газовой смеси одинаков для всех процессов
v2 = v1 ∙ ε,
где ε – степень сжатия – из исходных данных.
Расчет процессов.
Расчет изобарного процесса
2.1.1 Показатель политропы
n1=0
2.1.2 Давление в конце процесса, Па
P2=P1
2.1.3 Температура в конце процесса, К
Т2= Т1∙ ε
2.1.4 Средняя температура, К
Тср=(Т1+Т2)/2
Или в градусах Цельсия
tср= Тср – 273,15
2.1.5 Средние массовые теплоемкости компонентов при постоянном давлении Срсрi при средней температуре определяются для каждого из пяти газов.
Для углеводородных газов (метан, этан, пропан и т.д.) по графикам из пособия (рисунки 1.14 – 1.19) по температуре в градусах Кельвина..
Для неуглеводородных газов (воздух, азот, кислород и т.д.) рассчитывается по формулам из Приложения 1.1 практического пособия. Например, для воздуха по формуле вначале определяется мольная теплоемкость
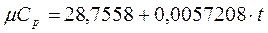 ,
,
где t = tср – средняя температура из предыдущего пункта, °С.
Затем рассчитывается массовая теплоемкость воздуха делением мольной теплоемкости воздуха на молярную массу воздуха
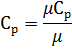
2.1.6 Средняя массовая теплоемкость газовой смеси при постоянном давлении, кДж/(кг∙°С)

где mi - массовые доли из п. 1.5.
2.1.7 Средняя массовая теплоемкость газовой смеси при постоянном объеме, кДж/(кг∙°С)
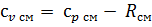
2.1.8 Показатель адиабаты k
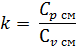
2.1.9 Термодинамическая работа процесса, кДж/кг
l= P1 ∙ (V2-V1)
2.1.10 Изменение внутренней энергии, кДж/кг
Δu = Cv см ∙(T2-Т1)
2.1.11 Изменение энтальпии, кДж/кг
Δh = Cp см ∙(T2-Т1)
2.1.12 Средняя массовая политропная теплоемкость процесса, кДж/(кг∙°С)
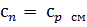
2.1.13 Теплота процесса, кДж/кг
q = Δh
2.1.14 Изменение удельной энтропии процесса, кДж/(кг ∙°С)

2.2 Расчет политропного процесса с n2
2.2.1 Показатель политропы
n=n2
2.2.2 Давление в конце процесса, Па

2.2.3 Температура в конце процесса, К
Т2= Т1/ ε(n-1)
2.2.4 Средняя температура, К
Тср=(Т1+Т2)/2
Или в градусах Цельсия
tср= Тср – 273,15
2.2.5 Средние массовые теплоемкости компонентов при постоянном давлении Срсрi при новой средней температуре определяются для каждого из пяти газов.
Для углеводородных газов (метан, этан, пропан и т.д.) по графикам из пособия (рисунки 1.14 – 1.19) по температуре в градусах Кельвина..
Для неуглеводородных газов (воздух, азот, кислород и т.д.) рассчитывается по формулам из Приложения 1.1 практического пособия. Например, для воздуха по формуле вначале определяется мольная теплоемкость
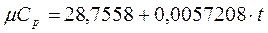 ,
,
где t = tср – средняя температура из предыдущего пункта, °С.
Затем рассчитывается массовая теплоемкость воздуха делением мольной теплоемкости воздуха на молярную массу воздуха
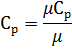
2.2.6 Средняя массовая теплоемкость газовой смеси при постоянном давлении, кДж/(кг∙°С)
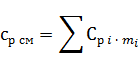
где mi - массовые доли из п. 1.5.
2.2.7 Средняя массовая теплоемкость газовой смеси при постоянном объеме, кДж/(кг∙°С)
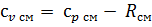
2.2.8 Показатель адиабаты k
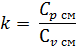
2.2.9 Термодинамическая работа процесса, кДж/кг
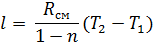
2.2.10 Изменение внутренней энергии, кДж/кг
Δu = Cv см ∙(T2-Т1)
2.2.11 Изменение энтальпии, кДж/кг
Δh = Cp см ∙(T2-Т1)
2.2.12 Средняя массовая политропная теплоемкость процесса, кДж/(кг∙°С)

2.2.13 Теплота процесса, кДж/кг
q = cn ∙ (T2 – T1)
2.2.14 Изменение удельной энтропии процесса, кДж/(кг ∙°С)
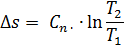
2.3 Расчет политропного процесса с n3=1
2.3.1 Показатель политропы
n=1, процесс изотермический;
2.3.2 Давление в конце процесса, Па

2.3.3 Температура в конце процесса, К
Т2= Т1
2.3.4 Средняя температура, К
Тср=(Т1+Т2)/2
Или в градусах Цельсия
tср= Тср – 273,15
2.3.5 Средние массовые теплоемкости компонентов при постоянном давлении Срсрi при новой средней температуре определяются для каждого из пяти газов.
Для углеводородных газов (метан, этан, пропан и т.д.) по графикам из пособия (рисунки 1.14 – 1.19) по температуре в градусах Кельвина..
Для неуглеводородных газов (воздух, азот, кислород и т.д.) рассчитывается по формулам из Приложения 1.1 практического пособия. Например, для воздуха по формуле вначале определяется мольная теплоемкость
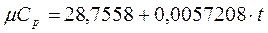 ,
,
где t = tср – средняя температура из предыдущего пункта, °С.
Затем рассчитывается массовая теплоемкость воздуха делением мольной теплоемкости воздуха на молярную массу воздуха
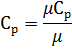
2.3.6 Средняя массовая теплоемкость газовой смеси при постоянном давлении, кДж/(кг∙°С)
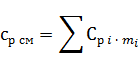
где mi - массовые доли из п. 1.5.
2.3.7 Средняя массовая теплоемкость газовой смеси при постоянном объеме, кДж/(кг∙°С)
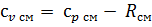
2.3.8 Показатель адиабаты k
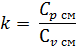
2.3.9 Термодинамическая работа процесса, кДж/кг
 = lпот
= lпот
2.3.10 Изменение внутренней энергии, кДж/кг
Δu = 0
2.3.11 Изменение энтальпии, кДж/кг
Δh = 0
2.3.12 Средняя массовая политропная теплоемкость процесса, кДж/(кг∙°С) равна бесконечности.
2.3.13 Теплота процесса, кДж/кг
q = l.
2.3.14 Изменение удельной энтропии процесса, кДж/(кг ∙°С)
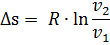
2.4 Расчет политропного процесса с n4
2.4.1 Показатель политропы
n=n4
2.4.2 Давление в конце процесса, Па

2.4.3 Температура в конце процесса, К
Т2= Т1/ ε(n-1)
2.4.4 Средняя температура, К
Тср=(Т1+Т2)/2
Или в градусах Цельсия
tср= Тср – 273,15
2.4.5 Средние массовые теплоемкости компонентов при постоянном давлении Срсрi при новой средней температуре определяются для каждого из пяти газов.
Для углеводородных газов (метан, этан, пропан и т.д.) по графикам из пособия (рисунки 1.14 – 1.19) по температуре в градусах Кельвина..
Для неуглеводородных газов (воздух, азот, кислород и т.д.) рассчитывается по формулам из Приложения 1.1 практического пособия. Например, для воздуха по формуле вначале определяется мольная теплоемкость
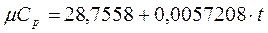 ,
,
где t = tср – средняя температура из предыдущего пункта, °С.
Затем рассчитывается массовая теплоемкость воздуха делением мольной теплоемкости воздуха на молярную массу воздуха
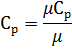
2.4.6 Средняя массовая теплоемкость газовой смеси при постоянном давлении, кДж/(кг∙°С)
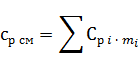
где mi - массовые доли из п. 1.5.
2.4.7 Средняя массовая теплоемкость газовой смеси при постоянном объеме, кДж/(кг∙°С)
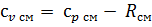
2.4.8 Показатель адиабаты k
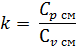
2.4.9 Термодинамическая работа процесса, кДж/кг
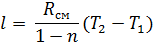
2.4.10 Изменение внутренней энергии, кДж/кг
Δu = Cv см ∙(T2-Т1)
2.4.11 Изменение энтальпии, кДж/кг
Δh = Cp см ∙(T2-Т1)
2.4.12 Средняя массовая политропная теплоемкость процесса, кДж/(кг∙°С)

2.4.13 Теплота процесса, кДж/кг
q = cn ∙ (T2 – T1)
2.4.14 Изменение удельной энтропии процесса, кДж/(кг ∙°С)
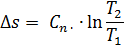
2.5 Расчет политропного процесса с n5
2.5.1 Показатель политропы
n=kзад=cp см/cv см,
где ср см – средняя изобарная теплоемкость газов из п.2.4;
сv см – средняя изохорная теплоемкость газов из п.2.4;
2.5.2 Давление в конце процесса, Па

2.5.3 Температура в конце процесса, К
Т2= Т1/ ε(n-1)
2.5.4 Средняя температура, К
Тср=(Т1+Т2)/2
Или в градусах Цельсия
tср= Тср – 273,15
2.5.5 Средние массовые теплоемкости компонентов при постоянном давлении Срсрi при новой средней температуре определяются для каждого из пяти газов.
Для углеводородных газов (метан, этан, пропан и т.д.) по графикам из пособия (рисунки 1.14 – 1.19) по температуре в градусах Кельвина.
Для неуглеводородных газов (воздух, азот, кислород и т.д.) рассчитывается по формулам из Приложения 1.1 практического пособия. Например, для воздуха по формуле вначале определяется мольная теплоемкость
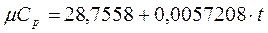 ,
,
где t = tср – средняя температура из предыдущего пункта, °С.
Затем рассчитывается массовая теплоемкость воздуха делением мольной теплоемкости воздуха на молярную массу воздуха
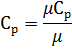
2.5.6 Средняя массовая теплоемкость газовой смеси при постоянном давлении, кДж/(кг∙°С)
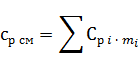
где mi - массовые доли из п. 1.5.
2.5.7 Средняя массовая теплоемкость газовой смеси при постоянном объеме, кДж/(кг∙°С)
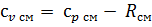
2.5.8 Уточняется показатель адиабаты kпол
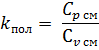
Если ǀкзад-кполǀ > 0,01, то принимаем новое кзад=кпол и возвращаемся в пункт 2.5.2.
2.5.9 Термодинамическая работа процесса, кДж/кг
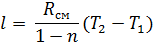
2.5.10 Изменение внутренней энергии, кДж/кг
Δu = Cv см ∙(T2-Т1)
2.5.11 Изменение энтальпии, кДж/кг
Δh = Cp см ∙(T2-Т1)
2.5.12 Средняя массовая политропная теплоемкость процесса, кДж/(кг∙°С)
с = 0
2.5.13 Теплота процесса, кДж/кг
q = 0
2.5.14 Изменение удельной энтропии процесса, кДж/(кг ∙°С)
2.6 Расчет политропного процесса с n6
2.6.1 Показатель политропы
n=n6
2.6.2 Давление в конце процесса, Па

2.6.3 Температура в конце процесса, К
Т2= Т1/ ε(n-1)
2.6.4 Средняя температура, К
Тср=(Т1+Т2)/2
Или в градусах Цельсия
tср= Тср – 273,15
2.6.5 Средние массовые теплоемкости компонентов при постоянном давлении Срсрi при новой средней температуре определяются для каждого из пяти газов.
Для углеводородных газов (метан, этан, пропан и т.д.) по графикам из пособия (рисунки 1.14 – 1.19) по температуре в градусах Кельвина..
Для неуглеводородных газов (воздух, азот, кислород и т.д.) рассчитывается по формулам из Приложения 1.1 практического пособия.
Затем рассчитывается массовая теплоемкость воздуха делением мольной теплоемкости воздуха на молярную массу воздуха
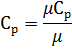
2.6.6 Средняя массовая теплоемкость газовой смеси при постоянном давлении, кДж/(кг∙°С)
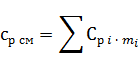
где mi - массовые доли из п. 1.5.
2.6.7 Средняя массовая теплоемкость газовой смеси при постоянном объеме, кДж/(кг∙°С)
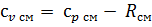
2.6.8 Показатель адиабаты k
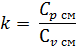
2.6.9 Термодинамическая работа процесса, кДж/кг
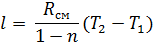
2.6.10 Изменение внутренней энергии, кДж/кг
Δu = Cv см ∙(T2-Т1)
2.6.11 Изменение энтальпии, кДж/кг
Δh = Cp см ∙(T2-Т1)
2.6.12 Средняя массовая политропная теплоемкость процесса, кДж/(кг∙°С)

2.6.13 Теплота процесса, кДж/кг
q = cn ∙ (T2 – T1)
2.6.14 Изменение удельной энтропии процесса, кДж/(кг ∙°С)
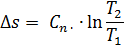
3. Заполнение сводной таблицы термодинамического расчета
4. Построение графиков в p-v и T-s диаграммах.
Таблица
СВОДНАЯ ТАБЛИЦА РЕЗУЛЬТАТОВ ТЕРМОДИНАМИЧЕСКОГО РАСЧЕТА
| Показатель политропы | 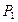
| 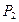
| 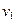
| 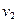
| 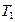
| 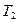
| 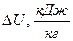
| 
| 
| 
| 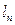
| 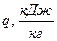
| 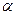
| Относительная ошибка расчета, % |

| 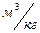
| 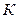
| 
| |||||||||||