Алкены
Алкены — ненасыщенные углеводороды, содержащие одну двойную связь.
Алкены бывают алифатические (ациклические) и карбоциклические (алициклические, т.е. циклоалкены). Общая формула алифатических алкенов C n H2 n (по составу изомерны циклоалканам), карбоциклических (в расчете на один цикл) — C n H2 n −2 (по составу изомерны алкинам, алкадиенам); M r (C n H2 n) = 14 n.
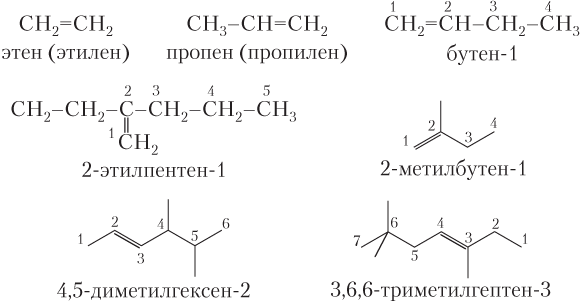
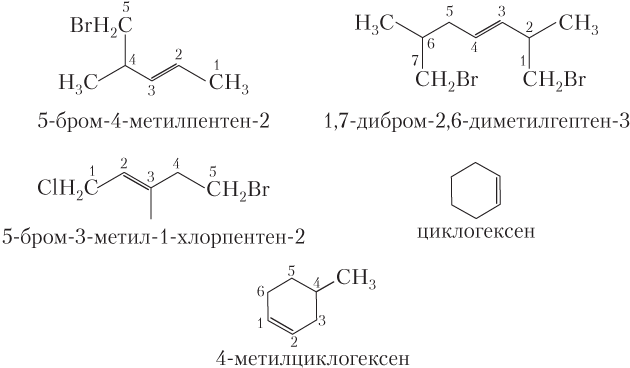
Для того чтобы назвать алифатический алкен (а также его галоген- и нитропроизводные) по систематической номенклатуре, выбирают главную — самую длинную углеродную цепь, обязательно содержащую двойную связь (в принципе, она может быть и не самой длинной в молекуле); атомы углерода в главной цепи всегда нумеруют с того конца, ближе к которому находится двойная связь.
Положение двойной связи указывается наименьшим номером атома углерода, образовавшего двойную связь, а ее наличие — суффиксом -ен (вместо -ан) в названии алкана, отвечающего главной углеродной цепи.
Углеводородные заместители перечисляются так же, как и для алканов (допустимы тривиальные названия простейших алкенов). Примеры названий алкенов и циклоалкенов.
Молекула простейшего алкена — этилена — плоская (ядра всех атомов C и H лежат в одной плоскости), валентные углы равны примерно 120°, длина двойной связи C=C — 0,133 нм, а ее энергия — 612 кДж/моль.
При образовании молекулы этилена формируются π- и σ-связи. Происходит это следующим образом: три из четырех валентных электронов каждого атома углерода участвуют в образовании трех σ-связей (две σ-связи C–H и одна C–C). При этом 2 р -орбитали атома углерода принимают грушеобразную форму (рис. 22.1, а), чтобы обеспечить более полное перекрывание между собой и 1 s -орбиталью атома водорода. По одному оставшемуся электрону от каждого атома углерода участвует в образовании π-связи углерод — углерод, при этом 2 р -орбитали, расположенные перпендикулярно плоскости σ-связей, перекрываются боковым способом.
Таким образом, двойная связь в молекуле этилена между атомами углерода состоит из одной σ-связи и одной π-связи. Модели строения молекулы этилена показаны на рис. 22.2.
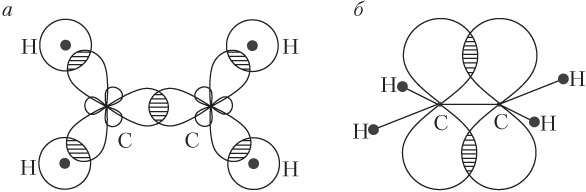
Рис. 22.1. Схема образования σ-связей (а) и π-связи (б) в молекуле этилена
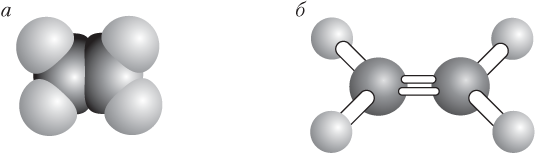
Рис. 22.2. Масштабная (а) и шаростержневая (б) модели молекулы этилена
Электронная формула этилена
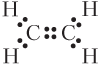
Зная, что энергия σ-связи равна 347 кДж/моль (энергия одинарной связи C–C в алканах), можно оценить энергию π-связи:
E π = E (C=C) − E σ = 612 − 347 = 265 (кДж/моль).
Видим, что энергия π-связи значительно меньше энергии σ-связи, поэтому для алкенов характерны реакции присоединения, связанные с разрывом π-связи. Большинство из них протекает по ионному механизму. Общая схема таких реакций:
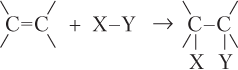
Строение углеродного скелета других алкенов показано на рис. 22.3.

Рис. 22.3. Строение молекулы пентена-2
В одной плоскости в молекулах алкенов лежат только атомы углерода, образовавшие двойную связь, и другие атомы, непосредственно связанные с ними.
Пример 22.1. Укажите номера атомов, которые лежат в одной плоскости, в молекуле алкена строения:
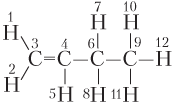
Решение. С учетом сказанного выше находим, что в одной плоскости лежат атомы, номера которых 1, 2, 3, 4, 5, 6; всего шесть атомов.
Ответ: 1, 2, 3, 4, 5, 6.
Изомерия алкенов
Изомерия алкенов богаче, чем алканов. Для алкенов характерны следующие виды структурной изомерии:
· изомерия углеродного скелета;
· изомерия положения двойной связи;
· межклассовая (изомерия циклоалканам).
Различные виды структурной изомерии алкенов показаны на примере алкена состава C5H10 (рис. 22.4).
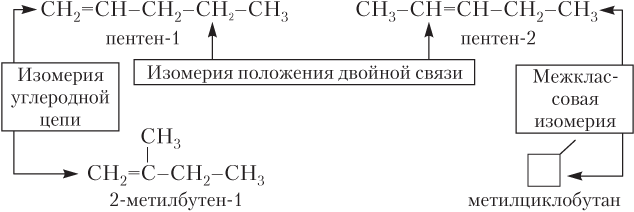
Рис. 22.4. Структурные изомеры (показаны не все) для алкена С5Н10
Наряду со структурной изомерией, алкены обладают пространственной цис -, транс -изомерией. Это объясняется тем, что в молекулах алкенов при обычных условиях невозможно вращение вокруг двойной связи. Поэтому атомы или группы атомов могут по-разному располагаться относительно плоскости, в которой находится π-связь.
Если одноименные (одинаковые) заместители расположены по одну сторону этой плоскости, образуется цис -изомер, если же по разные — транс -изомер (рис. 22.5).
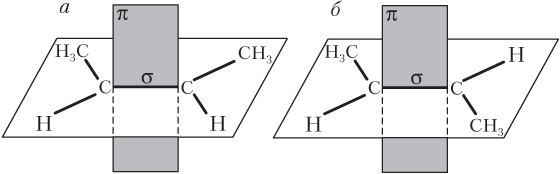
Рис. 22.5. Цис -, транс -изомерия бутена-2:
а — цис -изомер; б — транс -изомер
Цис -, транс -изомерия возможна не для всех алкенов.
Если хотя бы при одном атоме углерода, образовавшем двойную связь, оба заместителя одинаковые, то такой алкен геометрической изомерией не обладает