Железо и его соединения
План.
1) Особенности строения атомов железа и других переходных металлов.
2) Особенности физических и химических свойств
3) Нахождение в природе, получение и применение железа. Сплавы.
4) Соединения железа, их свойства. Роль железа в организме человека и применение его соединений в медицине.
5) Коррозия.
5) Другие важнейшие переходные металлы
Особенности строения атомов. Железо как представитель переходных металлов.
Железо находится в 4 периоде, в 8 группе, побочной подгруппе, относится к d-элементам. Т.е. на внешнем 4-ом электронном слое находится два электрона, идет заполнение предпоследнего уровня, 3d-подуровня.
Электронная конфигурация железа 1s2 2s2 2p6 3s2 3p6 4s2 3d6
 В химических процессах у атомов побочных металлов принимают участие не только s2-электроны последнего электронного уровня, но и электроны незавершенного d-подуровня. Такие электроны называют валентными. Как именно это происходит - зависит от конкретной конфигурации электронов (от энергии такой конфигурации).
В химических процессах у атомов побочных металлов принимают участие не только s2-электроны последнего электронного уровня, но и электроны незавершенного d-подуровня. Такие электроны называют валентными. Как именно это происходит - зависит от конкретной конфигурации электронов (от энергии такой конфигурации).
Для железа, как и для почти всех d-элементов, возможна степень окисления +2. При этом атом железа «теряет» два электрона которые находятся у него на внешнем 4 слое.
Т.е. у него остается 1s2 2s2 2p6 3s2 3p6 3d6
Такая конфигурация неустойчива. Напомним, максимально выгоден полностью заполненный слой (правило октета), потом - полностью заполненный подуровень, потом - наполовину заполненный подуровень). Значит степень окисления +2 будет для железа неустойчивой, нехарактерной. Потеряв еще один электрон железо приобретает наполовину завершенный подуровень 3d5 и стабильную степень окисления +3.
Возможны и другие степени окисления, но в школьном курсе такие соединения не изучаются, для железа они – экзотичны. Помните только, что железо может использовать при образовании соединений и остальные свои валентные электроны.
2. Физические свойства. Серебристо белый металл, проводит электрический ток и тепло, довольно мягкий, пластичный, тяжелый ρ 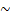 7,8 г/см3, тугоплавкий (температура плавления около 1530
7,8 г/см3, тугоплавкий (температура плавления около 1530 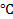 ) (существуют несколько аллотропических модификаций железа обозначаемых греческими буквами с разными температурами плавления и плотностями), имеет магнитные свойства.
) (существуют несколько аллотропических модификаций железа обозначаемых греческими буквами с разными температурами плавления и плотностями), имеет магнитные свойства.
Особенности химических свойств
Металл средней активности, восстановитель. Со слабыми окислителями железо окисляется до степени окисления +2, с сильными – до +3.
При нагревании (особенно в раздробленном состоянии) окисляется кислородом и другими неметаллами.
Fe + O2 → FeO∙Fe2O3 (Fe3O4 )
Fe + Cl2 → FeCl3
Fe + S → FeS
На воздухе в присутствии малейших следов влаги железо окисляется кислородом при обычной температуре. Этот процесс носит название «ржавление железа», а образовавшийся гидратированный оксид железа называют ржавчиной. А на химическом языке этот процесс, протекающий самопроизвольно при контакте железа с окружающей средой, принято называть коррозией.
Fe + H2O + O2 → Fe(OH)3 или Fe2O3∙nH2O
Окисляется железо и ионами водорода. Это может быть перегретый водяной пар или разбавленные растворы кислот. Обычно образуется смесь соединений со степенями окисления и +2 и +3. Можно сказать и иначе: образуются соединения со степенью окисления +2, которые кислородом воздуха легко окисляются до соответствующих соединений, со степенью окисления +3.
Т.е. в отсутствие воздуха окисление разбавленными кислотами-неокислителями проходит по уравнению:
Fe + HCl → FeCl2 + H2
Концентрированные кислоты-окислители при нагревании окисляют железо до более высокой степени окисления
Fe + H2SO4 (конц) → Fe2(SO4)3 + SO2 + H2O
Обратите внимание! Так эта реакция проходит при нагревании, а на холоду железо пассивируются, и с кислотами уже не взаимодействует. С растворами щелочей железо при н.у. тоже не взаимодействует.
Железо может окисляться ионами малоактивных металлов (Cu2+, Sn2+…):
Fe + Hg(NO3)2 → Hg+ Fe(NO3)2
Нахождение в природе
Содержание в земной коре – 5,1% по массе, второй после алюминия металл по распространенности. В свободном состоянии встречается только в составе метеоритов. А обычно - в виде соединений:
магнитный железняк (магнетит, Курская магнитная аномалия), красный железняк (гематит, Криворожский железно-рудный бассейн), бурый железняк, шпатовый железняк, железный колчедан (пирит) 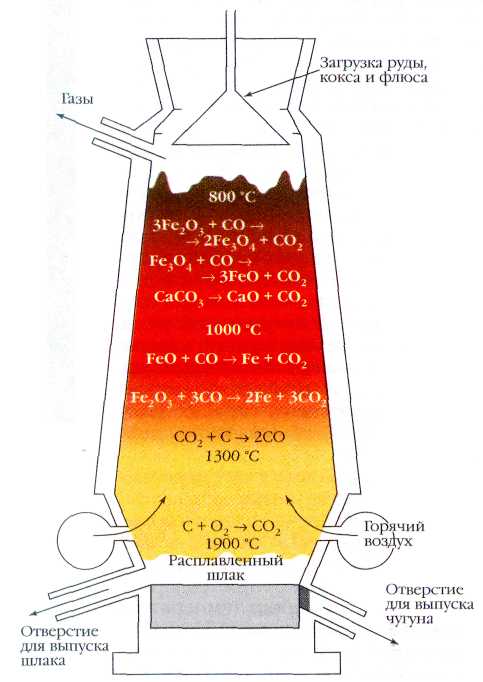 .
.
Получение
1). Восстановлением из оксидов (доменный процесс). Суть процесса: Fe2O3 + С → Fe + СO2, т.е. восстановление оксида железа, содержащегося в железной руде, коксом. Третьим компонентом необходимым для доменного процесса являются флюсы (СаСО3), они переводят тугоплавкие пустые породы (SiO2) в легкоплавкие и легкие шлаки (силикаты). Процесс проводят в домнах (печи высотой обычно около 25 м и диаметром до 10 м). Это непрерывный производственный процесс. Сверху засыпают шихту (кокс, руда, флюсы), снизу подают кислород. Восстановленное железо плавится и стекает в нижнюю часть печи – горн. Оттуда его периодически выпускают. Но это железо содержит много углерода. Т.е. в домнах получают не железо, а его твердый и хрупкий сплав – чугун.
Процесс удаления лишнего углерода из чугуна называют переделкой. Его суть заключается в окислении «лишнего» углерода кислородом. Этот процесс проводят в мартеновских печах или кислородных конвекторах. Сырьем кроме чугуна является железный лом, легирующие добавки, кислород. В результате получается ковкий сплав железа – сталь.
2). Можно восстанавливать железо с помощью электрического тока или активных металлов (алюминотермия), эти методы используется в странах, имеющих дешевую электроэнергию.
Применение железа
В чистом виде железо обычно не используют. Любые примеси, иногда очень незначительные, сильно изменяют свойства железа, а главное – усиливают его склонность к коррозии. Поэтому из чистого железа изготавливают только сердечники электромагнитов, якоря электродвигателей, а в основном используют сплавы железа. Для железа существует два вида сплавов: чугуны и стали. Чугуны содержат более 2% углерода, стали – меньше 2%.
Чугуны твердые, химически стойкие. В отличии от других сплавов чугун увеличивает объем при переходе от жидкого состояния к твердому. Чугун бывает:
Передельный (до 90% от всего выплавленного чугуна) - содержит углерод в основном в виде цементита. Используют для переработки в сталь. Очень твердый и хрупкий.
Литейный чугун содержит углерод в виде кристаллов графита. Механически литейный чугун менее хрупкий. Используют для изготовления литых изделий (станины станков, посуда…).
Стали содержат углерода менее 2% (а чаще и менее 1%), но содержат специальные добавки, которые называют легирующими (хром, никель, вольфрам, молибден, ванадий, кремний…). Сталь можно подвергать ковке и прокату, она более пластична, чем чугун, особенно при высокой температуре. Легирующие добавки сильно меняют свойства стали. Так можно изготавливают нержавеющие, инструментальные, жаропрочные стали и т.д.
Соединения железа.
Для всех переходных металлов характерна зависимость свойств соединений элемента от его степени окисления. Чем выше с.о. элемента тем сильнее проявляются кислотные и окислительные свойства его соединения.
Железо (II)
FeO (твердое черное вещество, нерастворимое в воде)
Fe(OH)2 (бледно-зеленый студенистый осадок, твердое вещество практически нерастворимое в воде)
FeCl2 и др. соли (кристаллические вещества бледно-зеленого цвета, используют в с/х как микроудобрение)
Основные свойства оксида и гидроксида (т.е. они легко вступают в реакцию нейтрализации с кислотами, а с основаниями практически не взаимодействуют)
FeО + HCl → FeCl2 + H2О
Fe(OH)2 + H2SO4 → FeSO4 + H2O
Восстановительные свойства (т.е. они очень легко окисляются)
Fe(OH)2 + O2 + H2O → Fe(OH)3
Железо (III)
Fe2O3 (твердое вещество красно-коричневого цвета, нерастворимое в воде, известно под названием железный сурик, используется как пигмент для красок, как окислитель в пиротехнических смесях)
Fe(OH)3 (бурый студенистый осадок, твердое вещество практически нерастворимое в воде, ржавчина)
FeCl3 и др. соли (кристаллические вещества коричневого или желтого цвета, используют для очистки воды, в медицине - как окислитель, бактерицидное средство)
Оксид и гидроксид имеют амфотерные свойства (т.е. они вступают в реакцию нейтрализации и с кислотами и со щелочами, но основные свойства преобладают)
Fe(OH)3 + HCl → FeCl3 + H2О
Fe(OH)3 + NaOH → Na3[Fe(OH)6]
Окислительные свойства у соединений проявляются слабо, т.е. взаимодействуют только с сильными восстановителями)
FeCl2 + H2S → FeCl2 + S + HCl