Приготовление и стандартизация растворов
В качестве стандартных растворов в методе нейтрализации, как правило, используются 0,01 – 0,1 н растворы соляной кислоты и едкого натра. Вследствие того, что исходные вещества для приготовления указанных растворов недостаточно чистые (HCl – это раствор хлористого водорода в воде, едкий натр – гигроскопичен, взаимодействует с углекислотой воздуха, образуя при этом соду), из них готовят растворы приблизительной концентрации. Растворы, приготовленные таким образом, называются стандартными растворами с установленным титром. Установочным веществом для соляной кислоты является тетраборат натрия. Его раствор приготовляется из точной навески и называется стандартным раствором с приготовленным титром. В свою очередь, соляная кислота является установочным веществом по отношению к едкому натру.
Методики приготовления стандартных растворов соляной кислоты и едкого натра, тетрабората натрия достаточно типичны для аналитической химии. Учитывая это, рассмотрим приготовление этих растворов подробно.
Лабораторная работа
Приготовление 0,1н раствора NaOH
Навеску едкого натра, необходимую для приготовления 500 мл 0,1 н раствора, рассчитывают по формуле: РNaOH, г = VNaOH 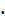 NNaOH
NNaOH 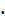 мЭNaOH. Величину мЭNaOH находят из уравнения реакции, в которой щелочь может участвовать:
мЭNaOH. Величину мЭNaOH находят из уравнения реакции, в которой щелочь может участвовать:
NaOH + HCl = NaCl + H2O.
1г – м NaOH взаимодействует с 1 г – и водорода
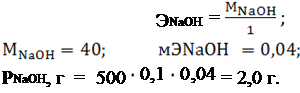
Отсюда: мЭNaOH = 
Учитывая то обстоятельство, что щелочь – вещество недостаточно чистое, навеску берут на технических весах больше на 10 % (т.е. 2,2 г) и растворяют в 500 мл воды в колбе.
Лабораторная работа
Приготовление раствора тетрабората натрия
Навескутетрабората натрия (Na2B4O7 x 10 H2O) рассчитывают по формуле:
Р Na2B4O7 x 10 H2O, г = V Na2B4O7 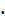 N Na2B4O7
N Na2B4O7 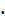 мЭ Na2B4O7 x 10 H2O.
мЭ Na2B4O7 x 10 H2O.
Значение мЭ Na2B4O7 x 10 H2O находят из уравнения реакции, в которой может участвовать тетраборат натрия:
Na2B4O7 + 2 HCl + 5 H2O = 2 NaCl + 4H3 BO3.
1г – м Na2B4O7 взаимодействует с 2 г – ионами водорода. Отсюда:
Э Na2B4O7 x 10 H2O = 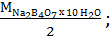 мЭ Na2B4O7 x 10 H2O =
мЭ Na2B4O7 x 10 H2O = 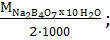
М Na2B4O7 x 10 H2O 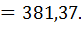
Для приготовления 250,00 г 0,1000 н раствора необходимая навеска численно равна
 Р Na2B4O7 x 10 H2O,г = 250 0,1 381,37/ 2
Р Na2B4O7 x 10 H2O,г = 250 0,1 381,37/ 2 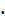 1000 = 4,7671 г.
1000 = 4,7671 г.
Эту навеску взвешивают на аналитических весах с точностью 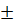 0,0001 г и количественно переносят в мерную колбу. Раствор в колбе доводят до метки
0,0001 г и количественно переносят в мерную колбу. Раствор в колбе доводят до метки
Лабораторная работа
Приготовление 0,1н раствора соляной кислоты
Соляную кислоту с концентрацией, приблизительно равной 0,1 н, готовят из концентрированной кислоты. Для определения концентрации этой кислоты, выраженной в г-экв /л, 100 мл кислоты наливают в цилиндр и измеряют плотность раствора аэрометром. По справочным таблицам находят соответствующую измеренной плотности нормальность. Объем кислоты, необходимый для приготовления разбавленного раствора, рассчитывают, используя следствие из закона эквивалентов:
V конц. = Vразб 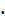 Nразб / Nконц.
Nразб / Nконц.
Например, необходимо приготовить 500 мл 0,1 н раствора соляной кислоты. Плотность концентрированной кислоты d = 1,17 г/см3. Кислоте с такой плотностью соответствует концентрация (н) = 10,97. Таким образом, необходимый объем кислоты равен:
V конц. = 500 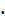 0,1 / 10,97
0,1 / 10,97 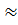 4,5 мл.
4,5 мл.
Готовят раствор следующим образом: в колбу наливают 250 мл воды, приливают 4,5 мл кислоты и остаток воды (250 мл). Закрывают колбу пробкой, тщательно перемешивают.
Лабораторная работа 4.