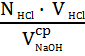Схема титрования
HCl
Na2B4O7
Тетрабората натрия является солью, образованной сильным
основанием и слабой кислотой. Вследствие гидролиза соли образуется сильное основание:
Na2B4O7 + 7 H2O = 2 NaОН + 4H3 BO3. Выделяющаяся щелочь взаимодействует с соляной кислотой: 2NaOH + 2HCl = 2NaCl + 2H2O.
Суммарно:
Na2B4O7 + 2 HCl + 5 H2O = 2 NaCl + 4H3 BO3.
Условие выбора индикатора:
рТинд 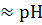 э.т.
э.т.
В эквивалентной точке раствор состоит из NaCl – соли сильного основания и сильной кислоты и H3 BO3 - слабой кислоты. Следовательно, рН раствора в эквивалентной точке определяется рН борной кислоты. Расчет величины рН слабой кислоты производится по формуле:
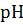 э.т = рН H3 BO3 = 1/2 рК H3 BO3 – 1/2 lg C H3 BO3.
э.т = рН H3 BO3 = 1/2 рК H3 BO3 – 1/2 lg C H3 BO3.
К H3 BO3 (по первой ступени) = 7,1 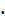 10-10; рК = 9,15.
10-10; рК = 9,15.
С учетом концентрации стандартного и титруемого раствора количество образующейся борной кислоты можно считать равным 0,1 г – экв.
Отсюда:
 э.т = рН H3 BO3 = 1/2 9,15 – 1/2 lg 10-1 = 5,07.
э.т = рН H3 BO3 = 1/2 9,15 – 1/2 lg 10-1 = 5,07.
Наиболее близкими по показателю титрования (рТ) к этой величине из имеющихся в лаборатории является индикатор метилоранж (рТ = Методика анализа
В две конические колбы отбирают пипеткой 25,00 мл стандартного раствора тетрабората натрия и добавляют 1-2 капли метилоранжа. При введении метилоранжа раствор окрашивается в желтый цвет, характерный для ионной формы индикатора. Титрование раствором HCl проводят до появления оранжевой окраски, которая свидетельствует о наступлении момента эквивалентности. Титрование проводят повторно. Результаты титрования не должны отличаться более чем на 0,10 мл.
Обработка результатов
До титрования были известны значения:
V Na2B4O7 = 25, 00 мл; N Na2B4O7  = 0,1000 н.
= 0,1000 н.
В результате титрования определены объемы соляной кислоты, израсходованные на реакцию с 25,00 мл 0,1000 н раствора Na2B4O7:
V1 HCl = ….мл; V2 HCl = ….мл; Vср HCl = ….мл.
Расчет нормальности соляной кислоты проводят по формуле:
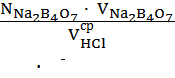 N HCl =
N HCl =
Расчет проводят с точностью до 1 10-4 г- экв.
Лабораторная работа
Стандартизация раствора едкого натра
Соляная кислота, нормальность которой точно известна, в свою очередь, используется для стандартизации приготовленного раствора щелочи.
Схема титрования Уравнение реакции:
NaOH NaOH + HCl = NaCl + H2O
HCl
Условие выбора индикатора: рТинд 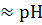 э.т.
э.т.
Состав раствора в эквивалентной точке:
NaCl рН = 7
H2O рН = 7
Следовательно, наиболее подходящим для данного титрования является индикатор с рТ =7. Однако, рассчитав рН раствора в начале и конце скачка по формулам, легко убедиться в том, что для 0,1 н растворов можно использовать индикатор с рТ от 4 до 10 (область скачка рН = 4…10). Поэтому в качестве индикатора в данном случае можно использовать фенолфталеин (рТ = 9).
Методика анализа
Бюретку, предварительно подготовленную к работе в соответствии с правилами работы в аналитической лаборатории, заполняют раствором щелочи, нормальность которой необходимо установить. В колбы для титрования отбирают по 25,00 мл стандартизованного раствора соляной кислоты, 1-2 капли индикатора фенолфталеина и титруют до появления неисчезающей в течение 30 с бледно – розовой окраски. Титрование проводят повторно. Объемы NaOH, пошедшие на титрование, не должны отличаться более чем на 0,10 мл.
Обработка результатов
До титрования были известны значения:
V HCl = 25,00 мл; N HCl  = 0,…. н. В результате титрования определены объемы:
= 0,…. н. В результате титрования определены объемы:
V1 NaOH = ….мл; V2 NaOH = ….мл; Vср NaOH = ….мл.
Расчет нормальности проводят по формуле:
N NaOH =