Обмен сложных белков
Обмен сложных белков отличается от обмена простых белков превращениями их простетических групп. Рассмотрим особенности обмена двух важных групп сложных белков – хромопротеидов и нуклеопротеидов.
Обмен хромопротеидов
С помощью хромопротеидов осуществляется обмен железа, перенос кислорода, защита от ультрафиолетового облучения, выработка секретов (желчь) и инкретов (серотонин) и т.д. Обмен пигментов тесно связан с функци-ей органов кроветворения, системой моноцитарных макрофагов, регулируется вегетативной нервной системой и эндокринными железами.
Интерес к обмену хромопротеидов обусловлен прежде всего биологически важными функциями гемоглобина, хлорофилла и цитохромов– этих сложных белков, относящихся к группе хромопротеидов. Особенности обмена гемоглобина могут служить иллюстрацией особенностей обмена хромопротеидов.
Гемоглобин, как известно, состоит из белка и простетической группы– гема. Гем представляет собой соединение, в молекулу которого входит атом двухвалентного железа и 4 замещенных пиррольных кольца, связанных между собой метиновыми группами. Скелетом гема является порфин, который в геме находится в форме протопорфирина. Белковая часть гемоглобина(глобин) различается своим химическим строением у разных видов организмов.
Гемоглобин, как и другие хромопротеиды(хлорофиллпротеиды, миоглобин и др.), попав с пищей в пищеварительный канал, гидролизуется пищеварительными ферментами, распадаясь на белок и простетическую группу(гем). Глобиновая часть подвергается обычным превращениям, которые свойственны простым белкам. Простетическая же группа гемоглобина – гем – окисляется в гематин. Гематин, так же как и хлорофилл, всасывается в кишечнике очень плохо и поэтому выделяется, в основном, с калом. Таким образом, простетическая группа хромопротеидов пищи не может быть использована для синтеза соответствующих сложных белков.
Иные превращения свойственны гемоглобину в тканях организма. Установлено, что все количество эритроцитов, а следовательно, и гемоглобина, полностью обновляется в организме на протяжении3-4 месяцев. Разрушение эритроцитов и распад гемоглобина происходит в клетках ретикуло-эндоте- лиальной системы (клетках костного мозга, купферовских клетках печени, клетках селезенки и др.).
В печени распад гемоглобина начинается с разрыва α-метиновой связи между 1 и 2 пиррольными кольцами порфиринового ядра. Реакция катализируется НАДФ-зависимой оксидазой и приводит к образованию вердоглобина (зеленого пигмента). В реакции участвуют в качестве кофакторов аскорбиновая кислота, ионы двухвалентного железа и др. В дальнейшем происходит распад вердоглобина на глобин, биливердин и железо. Биливердин в основном в печени превращается при восстановлении в билирубин– главный желчный
| 10. Обмен сложных белков |
пигмент у человека и плотоядных животных. Частично билирубин может образовываться также в селезенке и, по-видимому, в эритроцитах.
Образовавшийся свободный билирубин плохо растворим в воде и не дает прямой реакции с диазореактивом Эрлиха, так как легко адсорбируется на белках плазмы крови. Поэтому он получил название «непрямого билирубина».
Свободный билирубин (непрямой) является для организма токсическим веществом. Поступающий с током крови в печень и образовавшийся в печени свободный («непрямой») билирубин подвергается обезвреживанию в печени путем образования с глюкуроновой кислотой диглюкуронида билирубина(частично – моноглюкуронида). Он хорошо растворим в воде и дает прямую реакцию с диазореактивом. Поэтому он получил название«прямой» билирубин. Глюкуроновая кислота вступает в реакцию с билирубином в виде уридиндифосфатглюкуроновой кислоты в присутствии особого фермента глюкуронидтрансферазы.
Вжелчи всегда присутствует «прямой» (связанный) билирубин, который
сжелчью поступает в двенадцатиперстную кишку. В крови взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 2,5 до 12 мг/л или 8,6-20,5 мкмоль/л. Около 75% этого билирубина приходится на свободный «непрямой» билирубин. Повышение билирубина в крови до 20 мг/л (27 мкмоль/л) приводит к развитию желтухи. В крови количество и соотношение между«прямым» и «непрямым» билирубином резко меняется при поражениях печени, селезенки, костного мозга, болезнях крови и т.д., поэтому определение обеих форм билирубина имеет значение в клинике для дифференциальной диагностики различных форм желтухи.
Попадая вместе с желчью в пищеварительный тракт, желчные пигменты подвергаются здесь воздействию бактерий. При этом от диглюкуронида билирубина отщепляется глюкуроновая кислота и образовавшийся свободный билирубин восстанавливается в стеркобилиноген и в таком виде выводится с калом.
Под влиянием света и воздуха стеркобилиноген окисляется, превращаясь в стеркобилин. Механизм превращения билирубина в стеркобилиноген до конца не выяснен. Установлено, что вначале билирубин восстанавливается в мезобилиноген (уробилиноген), который всасывается и частично разрушается в печени, а частично выводится с мочой. В мочу также частично (в результате всасывания через систему геморроидальных вен) попадает стеркобилиноген. Увеличение последних в моче является свидетельством недостаточности печени (паренхиматозная желтуха), когда печень теряет способность извлекать эти пигменты из крови и обезвреживать их. Напротив, исчезновение пигментов из мочи при наличии билирубина и биливердина в крови является свидетельством полного прекращения поступления желчи в кишечник(закупорка желчного протока). Таким образом, определение содержания желчных пигментов в
| 10. Обмен сложных белков |
моче и в крови может служить важным лабораторным методом при дифференциальной диагностике заболеваний.
Синтез гемоглобина характеризуется многостадийностью. Считается, что пиррольные кольца порфиринового ядра гема синтезируются в организме человека и животных с использованием гликокола(глицина) и сукцинилкоэнзима А при участии фермента, содержащего фосфопиридоксаль.
С помощью меченных атомов установлено, что глицин является источником всех 4 атомов азота и8 атомов углерода тетрапиррольного кольца гема. Источником остальных 26 атомов углерода является сукцинил-КоА. Важнейшими промежуточными продуктами синтеза гема являются α-амино-β-кето- адипиновая кислота, d-аминолевулиновая кислота, порфобилиноген, порфирины.
Железо, необходимое для синтеза гема, доставляется ферритином – железопротеидом, находящимся в селезенке, печени и костном мозге.Путь синтеза гемоглобина свидетельствует о том, что гем, освобожденный из гемоглобина после распада эритроцитов, не используется для ресинтеза гемоглобина и в этом смысле распад гемоглобина является необратимым процессом.
Обмен нуклеопротеидов. Катаболизм нуклеиновых кислот
Начальным этапом превращений нуклеопротеидов пищи в пищеварительном канале следует считать отщепление нуклеиновой кислоты от белковой части нуклеопротеида. В желудке это происходит либо неферментативным путем под действием кислоты желудочного сока(если разрываются солеобразные связи между нуклеиновой кислотой и белком, имеющим щелочные свойства), либо под действием пепсина, либо, наконец, и под влиянием пепсина и под влиянием кислоты желудочного сока. В кишечнике расщепление нуклеопротеидов на белок и нуклеиновую кислоту происходит под влиянием соответствующих протеолитических ферментов (трипсина и других).
Отщепившийся в желудочно-кишечном тракте белок подвергается обычным для белка превращениям. Расщепление же нуклеиновых кислот происходит далее под влиянием особых ферментов поджелудочной железы и тонкого кишечника – специфических нуклеаз и неспецифических фосфодиэстераз. Они ускоряют реакции разрыва межнуклеотидных связей в молекулах нуклеиновых кислот. Нуклеазы, действующие на внутренние межнуклеотидные связи в молекулах РНК и ДНК, называются эндонуклеазами. При их участии осуществляется деполимеризация нуклеиновых кислот в основном до олигонуклеотидов. Нуклеазы, ускоряющие реакции последовательного отщепления нуклеотидов от РНК и ДНК, начиная с конца полинуклеотидной цепи, называются экзонуклеазами. Эти ферменты обеспечивают распад нуклеиновых кислот до
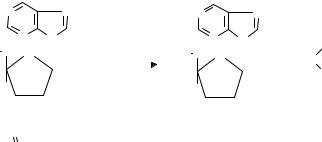
| 10. Обмен сложных белков |
отдельных мононуклеотидов. При этом различают эндо- и экзорибонуклеазы и эндо- и экзо-дезоксирибонуклеазы. Первые ускоряют реакции распада внутренних и внешних(концевых) межнуклеотидных связей в молекулах РНК. Вторые выполняют ту же роль в молекулах ДНК.
Существует также группа неспецифических эндо- и экзонуклеаз, действующих одновременно на РНК и ДНК.
Большинство нуклеаз являются гидролазами, однако, часть из них принадлежит к группе фосфотрансфераз (например, эндонуклеаза поджелудочной железы). В результате каталитического влияния разнообразных нуклеаз в полости пищеварительного тракта нуклеиновые кислоты распадаются на сложную смесь индивидуальных мононуклеотидов.
Образовавшиеся мононуклеотиды гидролизуются малоспецифическими и высокоспецифическими фосфатазами с образованием нуклеозидов и неорганического фосфата. В виде этих соединений(нуклеотидов и нуклеозидов) и происходит всасывание продуктов гидролиза нуклеиновых кислот. Всосавшиеся нуклеотиды и нуклеозиды частично используются в организме для синтеза простетических групп нуклеопротеидов.
В тканях нуклеиновые кислоты также распадаются до мононуклеотидов под влиянием тканевых нуклеаз – дезоксирибонуклеаз и рибонуклеаз, локализованных главным образом в митохондриях клеток.
Мононуклеотиды в тканях распадаются дальше до более простых соединений. Первый этап состоит в отщеплении остатка фосфорной кислоты под влиянием тканевых фосфатаз (или нуклеотидаз).
| NH2 | NH | |||||||||||||||||||||
| N | N | N | N | |||||||||||||||||||
| N | N | N | N | OH | ||||||||||||||||||
| OH | CH2 O | 3'-нуклеотидаза | OH | CH2 O | ||||||||||||||||||
| + H2O | + OH | P | O | |||||||||||||||||||
| H | H | H | H | OH | ||||||||||||||||||
| H | H | H | H | |||||||||||||||||||
| O | OH | OH | OH | |||||||||||||||||||
| аденозин | ||||||||||||||||||||||
| OH | P | OH | ||||||||||||||||||||
| O | ||||||||||||||||||||||
| аденозин-3'-фосфат |
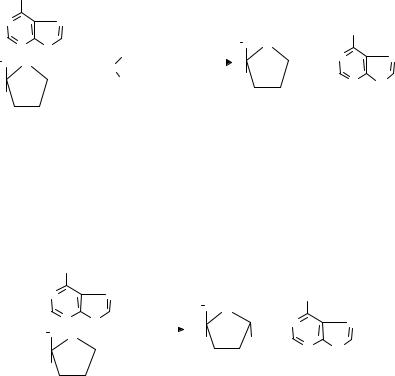
| 10. Обмен сложных белков |
Далее осуществляется перенос пентозы от нуклеозида на фосфорную кислоту. Реакция катализируется специфической для каждого нуклеозида рибозилтрансферазой (нуклеозидфосфорилазой).
| NH2 | O | ||||||||||||||||||||
| N | N | OH | |||||||||||||||||||
| OH | |||||||||||||||||||||
| P | NH2 | ||||||||||||||||||||
| OH | CH2 O | ||||||||||||||||||||
| N | N | O | |||||||||||||||||||
| OH | CH2 O | OH аденозинфосфорилаз а | + | N | N | ||||||||||||||||
| + OH P | O | H | H | ||||||||||||||||||
| H | H | OH | H | H | N NH | ||||||||||||||||
| H | H | ||||||||||||||||||||
| OH | OH | аденин | |||||||||||||||||||
| рибозо-1-фосфат | |||||||||||||||||||||
| OH | OH | ||||||||||||||||||||
аденозин
Таким путем в результате распада нуклеозидов образуются пентозо-1- фосфат и все виды пуриновых и пиримидиновых оснований, участвующих в построении нуклеиновых кислот.
Надо сказать, что нуклеозиды могут расщепляться не только путем переноса пентозы от нуклеозида на фосфорную кислоту, но и гидролитическим путем при участии ферментов нуклеозидаз:
| NH2 | ||||||||||||||||
| N | N | OH | NH2 | |||||||||||||
| нуклеозидаза OHCH2 O | ||||||||||||||||
| N | ||||||||||||||||
| N | + H2O | + N | N | |||||||||||||
| H | H | |||||||||||||||
| OHCH2 O | ||||||||||||||||
| H | H | N | NH | |||||||||||||
| H | H | |||||||||||||||
| H | H | OH | OH | аденин | ||||||||||||
| рибоза | ||||||||||||||||
| OH | OH | |||||||||||||||
| аденозин |
Образующиеся пентозо-1-фосфат и пентоза включаются в реакции обмена, характерные для углеводов.
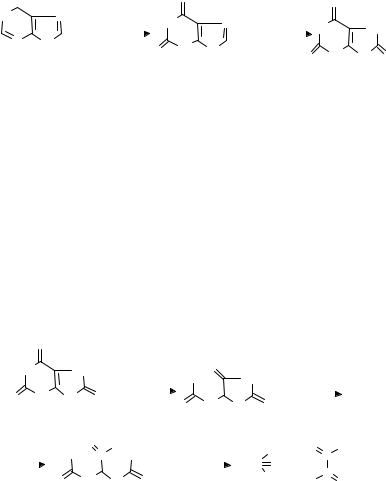
Пуриновые и пиримидиновые основания претерпевают последующие изменения и превращаются в те или иные простейшие азотсодержащие продукты, которые либо выводятся из организма, либо откладываются в нем. Первая фаза распада пуриновых и пиримидиновых оснований заключается в дезаминировании под влиянием специфических аминогидролаз тех из них, которые имеют аминогруппу. В результате пуриновые основания – аденин превращается в гипоксантин, а гуанин – в ксантин:
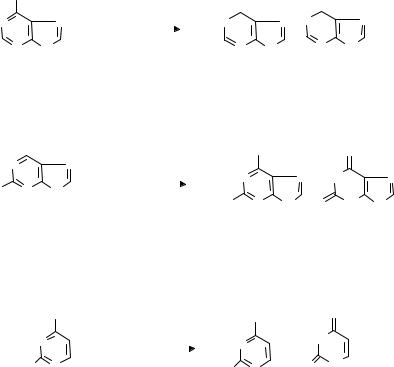
| 10. Обмен сложных белков | ||||||||||||||||||
| NH2 | аденинаминогидролаза | OH | O | |||||||||||||||
| N | N | N | HN | N | ||||||||||||||
| + H2O | NH3 + N | |||||||||||||||||
| N | NH | N | NH | N | NH | |||||||||||||
| аденин | гипоксантин | гипоксантин | ||||||||||||||||
| (енольная форма) | (кетоформа) | |||||||||||||||||
| OH | OH | |||||||||||||||||
| O | ||||||||||||||||||
| N | N | гуанинаминогидролаза | ||||||||||||||||
| H2N | N | + H2O | NH3 + | N | N | NH | N | |||||||||||
| NH | ||||||||||||||||||
| HO | N | NH | O | NH NH | ||||||||||||||
| гуанин | ксантин | |||||||||||||||||
| ксантин | ||||||||||||||||||
| (енольная форма) | (кетоформа) |
Пиримидиновое основание, содержащее аминогруппу– цитозин – переходит в урацил:
| NH2 | OH | O | ||||||
| N | цитозинаминогидролаза | NH | ||||||
| + H2O | NH | + | N | + | ||||
| NH | ||||||||
| HO | N | HO | N | O | ||||
| цитозин | урацил | |||||||
| урацил | ||||||||
| (енольная форма) | (кетоформа) |
Дезаминирование идет не только на уровне свободных пиримидиновых и пуриновых оснований, но и на уровне нуклеозидов и нуклеотидов, причем, в последнем случае с большей интенсивностью.
Дальнейшая судьба дезаминированных пуриновьх и пиримидиновых оснований различна. Гипоксантин и ксантин окисляются в мочевую кислоту. Реакция катализируется ксантиноксидазой, представляющей собой молибденсодержащий флавопротеид.
| 10. Обмен сложных белков | ||||||||||
| O | O | O | ||||||||
| ксантиноксидаза | ксантиноксидаза | |||||||||
| NH | N | NH | N | |||||||
| N | + 1/2 O2 | + 1/2 O2 | NH | HN | ||||||
| NH | O | NH | NH | NH | ||||||
| гипоксантин | O | NH O | ||||||||
| ксантин | мочевая кислота |
Мочевая кислота является конечным продуктом распада пуриновых оснований у человека и некоторых животных(человекообразных обезьян, птиц, рептилий, тутового шелкопряда) и выводится из организма с мочой.
В норме концентрация мочевой кислоты в цельной крови человека составляет 0,18-0,24 ммоль/л, а в сыворотке крови 0,1-0,4 ммоль/л. При нарушении обмена пуриновых оснований(при подагре, заболеваниях почек, при заболеваниях, сопровождающихся усиленным распадом нуклеопротеидов– лейкозах, диабете, аллергии и др.) содержание мочевой кислоты может значительно увеличиваться (гиперурикемия). Гиперурикемия – главный симптом такого заболевания как подагра. При подагре уровень мочевой кислоты в сыворотке крови возрастает до 0,47-0,89 и даже до 1,1 ммоль/л.
У большинства животных и растений мочевая кислота не является конечным продуктом распада пуриновых оснований– происходит дальнейший ферментативный распад мочевой кислоты, причем, у большинства растений и амфибий – до мочевины и глиоксиловой кислоты. Этот распад мочевой кислоты можно изобразить следующим образом:
| O | ||||||||||||||
| NH | HN | урикооксидаза | O | |||||||||||
| (уриказа) | аллантоиназа | |||||||||||||
| NH2 | HN | |||||||||||||
| + 1/2 O2+ H2O | + H O | |||||||||||||
| O | ||||||||||||||
| O NH | NH | - CO2 | ||||||||||||
| O | NH | NH | O | |||||||||||
| мочевая кислота | ||||||||||||||
| аллантоин | ||||||||||||||
| O | OH | NH2 | O | OH | ||||||||||
| NH2 | + H2O | |||||||||||||
| C | NH2 | C | ||||||||||||
| 2 C | O | + | ||||||||||||
| O | NH | NH O | NH2 | C | O | |||||||||
| H | ||||||||||||||
| аллантоиновая кислота | мочевина | глиоксиловая | ||||||||||||
| кислота |
В отличие от пуриновых оснований дезаминированные пиримидиновые основания подвергаются восстановлению. В частности, урацил переходит в
дигидроурацил. Донором атомов водорода служит НАД.Н. Далее дигидро-
урацил гидролизуется в N-карбамил-β-аланин, который гидролизуется в свою очередь до β-аланина и карбаминовой кислоты. Последняя либо используется
| 10. Обмен сложных белков |
для синтеза мочевины, либо распадается до углекислого газа и аммиака. Все эти реакции катализируются соответствующими ферментами:
| O | O | |||||||||||||||
| HN | дигидроурацилдегидрогеназа | дигидропиримидиназа | ||||||||||||||
| + НАД.Н2 | HN | + H2O | ||||||||||||||
| O | NH | - НАД | ||||||||||||||
| O | NH | |||||||||||||||
| урацил | ||||||||||||||||
| дигидроурацил | ||||||||||||||||
| O | OH | COOH | ||||||||||||||
| C | N-карбамил-бета-аланин- | |||||||||||||||
| CH2 | ||||||||||||||||
| NH2 CH2 | + NH2 | COOH | ||||||||||||||
| C | CH | амидогидролаза | ||||||||||||||
| + H O | CH2 карбаминовая кислота | |||||||||||||||
Поиск по сайту©2015-2025 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2022-10-01 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд Интересно: |