Задача(8-9) - 1.
Из массового соотношения реагентов можно перейти к количественному: n(Na2SO4): n(C): n(CaCO3) = (3/142): (1/12): (2/100) = 0,021: 0,083: 0,02 ≈ 1: 4: 1. 2 балла
Также несложно догадаться, что выделяющийся газ – СО (угарный газ), который, окисляясь до СО2 (углекислый газ), осаждает СаСО3 (карбонат кальция, негашёная известь) из известковой воды. 1 балл
Собрав все эти данные воедино, можно составить уравнение реакции 1:
 Na2SO4 + 4C + CaCO3 960 C Na2CO3 + CaS + 4CO 2 балла
Na2SO4 + 4C + CaCO3 960 C Na2CO3 + CaS + 4CO 2 балла
Реакция 2: 2СО + О2 → 2СО2 0,5балла
Реакция 3: Са(ОН)2 + СО2 → СаСО3 + Н2О 0,5балла
При обработке водой смеси соды и сульфида кальция (СаS) происходит гидролиз сульфида (реакция 4): СaS + 2Н2О → Са(ОН)2 + Н2S с образованием сероводорода и гидроксида кальция (гашёной извести). 1 балл
Окислительно-восстановительная. 0,5балла
Плохо растворимый карбонат кальция переходит в хорошо растворимый гидрокарбонат, ‘муть’ исчезает: CaCO3 + CO2 + H2O → Ca(HCO3)2 0,5балла
Это минерал трона NaHCO3*Na2CO3 * H2O, египетская соль 1 балл
 Угарный газ применяется для восстановления металлов из их оксидов (например, FeO + CO → Fe +CO2), также его можно применять для получения карбонилов (Ni + 4CO → Ni(CO)4), метилового спирта (CO +2H2 давление CH3OH), и т. д. 0,5*2= 1 балл
Угарный газ применяется для восстановления металлов из их оксидов (например, FeO + CO → Fe +CO2), также его можно применять для получения карбонилов (Ni + 4CO → Ni(CO)4), метилового спирта (CO +2H2 давление CH3OH), и т. д. 0,5*2= 1 балл
Всего 10 баллов
Задача(8-9) -2.
- Жёлто-зелёный газ, это, вероятнее всего, хлор.
Реакция 1: 6KOH(гор.) + 3Cl2 → KClO3 + 5KCl + 3H2O 2 балла
Реакция 2: 2KClO3 диоксид Mn, 400С → 2KCl + 3O2 2 балла
Реакция 3: 4KClO3 400С → KCl + 3KClO4 2 балла
Значит, А – хлорат калия KClO3, Б – хлор Cl2, В – хлорид калия KCl, Г – кислород (плотность по фосфину= 32/34 = 0,94), Д – перхлорат калия KClO4.
2*1 балл=2 балла
2. Реакция 4: KClO4 550-620С → KCl + 2O2. 2 балла
Всего 10 баллов
Задача(8-9) -3.
1. Определим массу продуктов окисления
m окисл.= mобразца. ω окисл. =2 г * 1,5% /100% = 0,03 г 1 балл
2. Найдем массу чистого металла (очевидно, что это натрий) mмет. = mобразца - m окисл.= 2г – 0,03г = 1,97г 1 балл
3. Найдем массу продукта – гидроксида натрия:
2Na + 2H2O 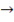 2NaOH + H2 1 балл
2NaOH + H2 1 балл
m 1(NaOH) = 1,97г * 80г / 46г = 3,43г 1 балл
2Na2О2 + 2H2O 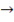 4NaOH + О2 2 балла
4NaOH + О2 2 балла
m 2(NaOH) = 0,03г * 160г / 156г = 0,031г 1 балл
Общая масса гидроксида натрия
m (NaOH) = 3,43г + 0,03г = 3.46г 1 балл
4. Определим массу образовавшейся поваренной соли:
NaOH + HCl 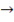 NaCl + H2O 1 балл
NaCl + H2O 1 балл
m (NaCl) = 3,46г *58,5г / 40г = 5,06г 1 балл
Всего 10 баллов
Задача(8-9) -4.
CuO + 2HCl 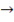 CuCl2 + H2O голубой раствор 2 балла
CuCl2 + H2O голубой раствор 2 балла
Fe2O3 + 6HCl 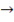 2FeCl3 + 3H2O желто-бурый цвет 2 балла
2FeCl3 + 3H2O желто-бурый цвет 2 балла
Ag + HCl 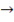 реакция не идет 2 балла
реакция не идет 2 балла
Fe + 2HCl 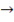 FeCl2 + H2 зеленоватый раствор,
FeCl2 + H2 зеленоватый раствор,
выделение газа 2 балла
Всего 8 баллов
Задача(8-9) -5.
Все соли аммония при нагревании разлагаются: 1 балл
t
NH4Cl 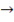 N H3 + HCl 1 балл
N H3 + HCl 1 балл
Газообразные продукты разложения хлорида аммония улетучиваются, остается одна соль.
Всего 2 балла
Решения задач для 10 класса
Задача 10-1.
1. Обозначим простейшую формулу искомого углеводорода СхНy, где х = n(C), y = n(Н). 1 балл
2. Определим массу атомов углерода в оксиде:
44 г СО2 содержит 12 г атомов углерода
3,434 г СО2 содержит m1 г атомов углерода
m1 = 0,9376 г 1 балл
3. Определим массу атомов водорода в воде:
18 г Н2О содержит 2 г атомов водорода
0,562 г Н2О содержит m2 г атомов водорода
m2 = 0,0624 г 1 балл
4. Соотношение атомов углерода и водорода в углеводороде:
n(C): n(Н) = m1 /12: m2 /1 = 0,9376 / 12: 0,0624 /1 = 5: 4 1 балл
Следовательно, простейшая формула будет иметь вид С5Н4 (Мr = 64). 1 балл
5. Установим молекулярную формулу вещества:
По условию, пары 1 моль углеводорода занимают в четыре раза меньший объем, чем 1 моль кислорода. Отсюда, Мr(СхНy) = 4 Мr(О2) = 4 32 = 128, т.е. молекулярная формула углеводорода С10Н8, так как Мr(СхНy) = 2 Мr(С5Н4). 3 балла
6. Можно предложить большое число структурных формул веществ состава С10Н8. Важнейшими из них являются нафталин и его изомеры. 2 балла
Всего 10 баллов
Задача 10-2.
1. Реакция 1 – Na2SO4 + BaCl2 → BaSO4 + 2NaCl 0,5 балла
Реакция 2 – BaSO4 + 4С 1100 С → BaS + 4CO 1 балл
Реакция 3 – BaS + 2H2O → Ba(OH)2 + H2S 0,5 балла
Зная, что свойства целестина схожи со свойствами BaSO4 (А) и используя информацию о реакциях 4-6, можно написать:
Реакция 4 – X SO4 + 3С 1100 С → X S + 2СО + СО2 1 балл
Реакция 5 – Ba(OH)2 + CO2 → BaCO3 + H2O 0,5 балла
Реакция 6 – X S + 2H2O кипячение → X (OH)2 + H2S 1 балл
Таким образом, А – BaSO4; Б – BaS; В – CO; Г – H2S; Д – X S; Е – СО2
2. Найдём количество выделившегося в реакции 4 углекислого газа: из уравнения реакции 5 υ(СО2) = υ (BaCO3) = m(BaCO3):М(BaCO3) = 0,254 моль. 1 балл 3. Определим количество сероводорода, выделившегося в реакции 3:
По уравнениям реакций 4 и 6: υ(H2S) = υ(X SO4) = υ(СО2), тогда количество сероводорода (реакция 3) равно 0,254 – 1,21:22,4 = 0,2 моль. Следовательно, и количество сульфата бария равно 0,2 моль. 2 балла
4. Определим элемент Х. Примем за х атомный вес элемента Х и составим уравнение:
m(BaSO4) = m(X SO4);
233,3*0,2 = (x + 96)*0,254;
х = 87,7 г/моль, что соответствует стронцию Sr.
Значит, химическая формула целестина – SrSO4. 2 балла
5. Барит, или тяжёлый шпат. 0,5 балла
Всего 10 баллов
Задача 10-3.
1 Представим уравнение реакции в общем виде: 2ROH + 2Na → 2RONa + H2, где R= CnH2n+1 2 балла
2 Определяем количество вещества водорода:
υ = V / Vm = 5,6 л / 22,4 л/моль = 0,25 моль 2 балла
3 По уравнению реакции: 2 υ ROH = υ H2, отсюда υ ROH = 0,5 моль 2 балла
4 Молярная масса спирта М = m/ υ = 16г / 0,5моль = 32 г/моль, а Мr = 32 1 балл
5 Определяем молекулярную формулу спирта CnH2n+1OH
Мr = 12n + 2n + 1 + 16 + 1 = 32; n = 1; CH3OH - метанол 1 балл
6 Рассчитаем объем водорода:
По уравнению реакции: V (H2) = 0,5 моль. 22,4 л/моль = 11,2 л 2 балла
Всего 10 баллов
Задача 10-4.
Логично предположить, что X – уксусная кислота: она незаменима в быту и как органическая кислота проявляет слабые кислотные свойства. Проверим это по реакции с NaOH. Уравнение реакции:
CH3COOH + NaOH → CH3COONa + H2O. 1 балл
Было взято n1 = (204*0,05)/60 = 0,17 моль уксусной кислоты, и получилось n2 = 13,94/82 = 0,17 моль ацетата натрия (A). Следовательно, наше предположение верно.
1 балл
Сплавление ацетата натрия с NaOH – типичный пример реакции Дюма: 1 балл
СH3COONa + NaOH сплавление → СH4 + Na2CO3. 0,5 балла
Выделяющийся при этом газ Б – метан (природный газ, болотный газ). 0,5 балла Далее метан вступает в реакцию с хлором:
CH4 + Cl2 свет → CH3Cl + HCl. 0,5 балла
При пропускании образующегося хлорметана (В) над бензолом в присутствии AlCl3 образуется толуол (Г) по механизму Фриделя-Крафтса: 1 балл
CH3Cl + C6H6 кат → C6H5CH3 + HCl, содержащий 84/92=91,3% углерода по массе.
1 балл
При нитровании толуола образуется 2,4,6-тринитротолуол (Д) (тол, тротил): 1 балл
C6H5 CH3 + 3HNO3 серная кислота → С6H2CH3(NO2)3 +3H2O. 0,5балла
Процесс кристаллизации ацетата натрия – экзотермический процесс, что и используется в грелках. 1 балл
Принимаются любые верные способы. 2 способа = 2*0,5 =1 балл
Всего 10 баллов