В общем виде для системы нейтрализации сильной щелочи сильной кислотой (или наоборот) зависимость рН от количества добавленного титранта будет выглядеть так:
Для щелочной области титрования (при рН>7.0):
рН = 14 + lg (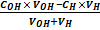 ), (7)
), (7)
где СH, COH нормальные концентрации кислоты и щелочи, моль*экв/л; VH, VOH – объемы кислоты и щелочи в системе (начальный объем титруемого вещества и объем добавленного титранта), мл или л.
Для кислотной области титрования (при рН<7.0):
рН = - lg (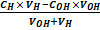 ), (8)
), (8)
Очевидно, что при достижении точки эквивалентности (рН=7,00) формулы (7) и (8) не будут иметь решения, поскольку выражение под знаком логарифма принимает нулевое значение.
Однако, это не означает, что система не может иметь показатель рН равный точно 7,00.
Дело в том, что при оценке рН системы нейтрализации мы принимаем в расчет только те ионы, влияющие на кислотность (Н+ и ОН-), которые происходят от диссоциации щелочи и кислоты, но пренебрегаем ионами кислотности, происходящими от диссоциации самой водной среды.
Таким образом, когда все привнесенные в систему ионы кислотности полностью нейтрализованы (реакция нейтрализации находится точно в точке эквивалентности), концентрации ионов Н+ и ОН- определяется только ионным произведением воды (собственной диссоциацией молекул воды):
KW = [H+]*[OH-] = 10-14 (2)
Откуда
рН = рОН = - lg10-7 = 7.0 (3)
Имея формулы (7) и (8), можно построить график зависимости рН системы нейтрализации от объема добавленного титранта.
В наших примерах, представленных в серии видеоклипов https://www.youtube.com/watch?v=lbaZaLRbAGk&list=PLYloU8adTZu7kT_j98_Rv6nGFSLavjikG, использовано два варианта титрования 20 мл щелочного раствора соляной кислотой: 0,1 н. HCl + 0,05 н. NaOH и 0,01 н. HCl + 0,05 н. NaOH.
Попробуем построить график рН=f(Vтитранта) для обоих вариантов титрования.
По оси абсцисс отложен объем добавляемого титранта в мл (в нашем случае – HCl), по оси ординат – рН системы.
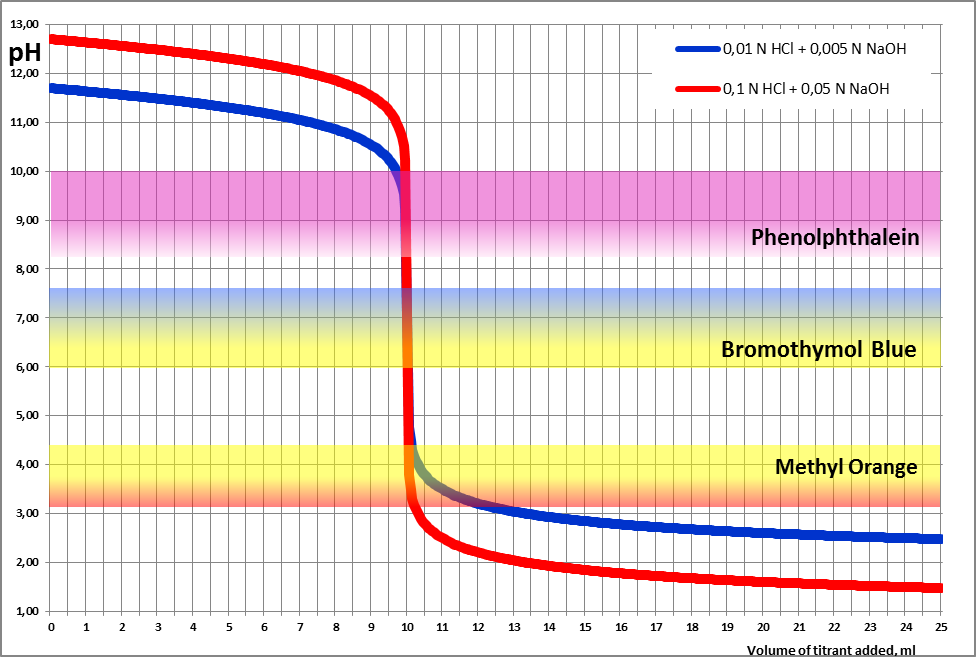
Также на графике представлены три индикатора: фенолфталеин, бромтимоловый синий и метиловый оранжевый в областях рН, соответствующих переходам их окраски.
Несмотря на то, что область перехода окраски на шкале рН сильно отличается для разных индикаторов, все они могут быть использованы для титрования сильной щелочи сильной кислотой, и наоборот.
Это объясняется выраженным скачком рН в районе точки эквивалентности, т.е. резким и значительным изменением рН системы при добавлении исчезающее малого количества титранта. Величина скачка такова, что включает в себя несколько несмежных интервалов перехода окраски разных индикаторов.
Как видно из приведенных на графике данных, концентрации компонентов системы (кислоты и щелочи) не влияют на характер скачка рН, но определяют его величину: для более концентрированных растворов скачок рН более выражен (занимает бóльший диапазон рН).
Зависимость рН системы от объема добавленного титранта называется кривой титрования.
Связь кривой титрования с реальным процессом титрования щелочи кислотой можно посмотреть на видео: https://youtu.be/Nqt1kMRFWrc