
Химические свойства.
Химические свойства непредельных карбоновых кислот обусловлены как свойствами карбоксильной группы, так и свойствами двойной связи. Специфическими свойствами обладают кислоты с близко расположенной от карбоксильной группы двойной связью - альфа, бета-непредельные кислоты. У этих кислот присоединение галогеноводородов и гидратация идут против правила Марковникова:
СН2=СН-СООН + НВr -> СН2Вr-СН2-СООН
При осторожном окислении образуются диоксикислоты:
СН2=СН-СООН + [О] + Н20 -> НО-СН2-СН(ОН)-СООН
При энергичном окислении происходит разрыв двойной связи и образуется смесь разных продуктов, по которым можно установить положение двойной связи. Олеиновая кислота С17Н33СООН - одна из важнейших высших непредельных кислот. Это - бесцветная жидкость, затвердевает на холоде. Ее структурная формула: СН3-(СН2)7-СН=СН-(СН2)7-СООН.
N46
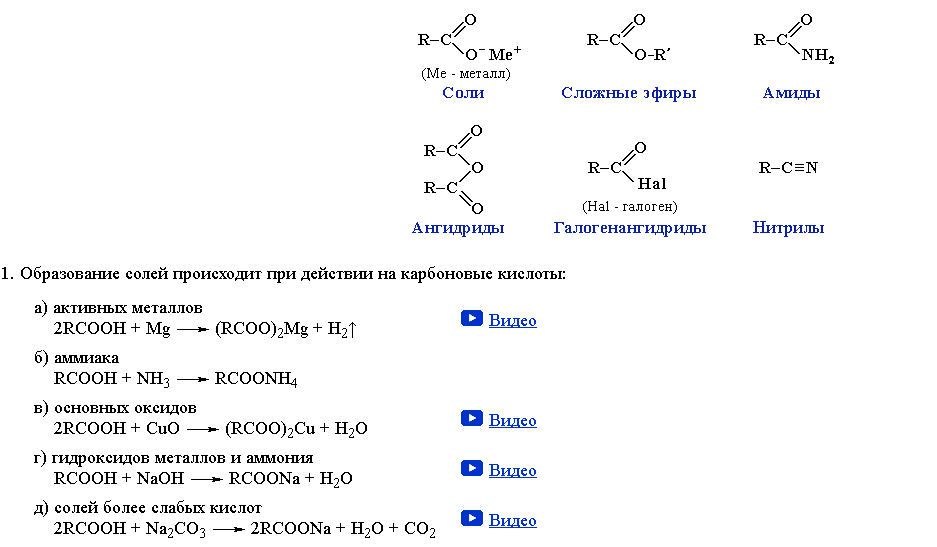
Производные карбоновых кислот
Производные карбоновых кислот - это соединения, в которых гидроксильная группа карбоновой кислоты замещена другой функциональной группой.

Просты́е эфи́ры — органические вещества, имеющие формулу R-O-R', где R и R' — углеводородные радикалы. Следует, однако, учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами

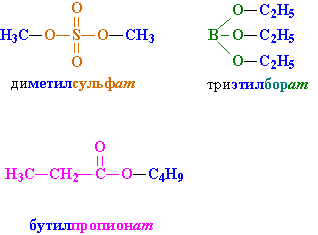
Сло́жные эфи́ры (или эсте́ры) — производные оксокислот (как карбоновых, так и неорганических) с общей формулой RkE(=O)l(OH)m, где l ≠ 0, формально являющиеся продуктами замещения атомов водорода гидроксилов —OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический); рассматриваются также как ацилпроизводные спиртов. В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов (тиолов, селенолов и теллуролов)[1].
Отличаются от простых эфиров (этеров), у которых два углеводородных радикала соединены атомом кислорода (R1—O—R2)
Ами́ды — производные оксокислот (как карбоновых, так и минеральных) RkE(=O)l(OH)m, (l ≠ 0), формально являющиеся продуктами замещения гидроксильных групп -OH кислотной функции на аминогруппу (незамещенную и замещенную); рассматриваются также как ацилпроизводные аминов. Соединения с одним, двумя или тремя ацильными заместителями у атома азота называются первичными, вторичными и третичными амидами, вторичные амиды именуются также имидами.
Амиды карбоновых кислот — карбоксамиды RCO-NR1R2 (где R1 и R2 — водород, ацил либо алкильный, арильный или другой углеводородный радикал) обычно именуются амидами, в случае других кислот в соответствии с рекомендациями IUPAC при именовании амида в качестве префикса указывается название кислотного остатка, например, амиды сульфокислот RS(=O2NH2 именуются сульфамидами.

Хлорангидри́д карбо́новой кислоты́ (ацилхлорид) — производное карбоновой кислоты, в которой гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора. Общая формула R-COCl. Первый представитель с R=H (хлористый формил) не существует, хотя смесь CO и HCl в реакции Гаттермана - Коха ведёт себя подобно хлорангидриду муравьиной кислоты.
Получение
R-COOH + SOCl2 → R-COCl + SO2↑ + HCl↑
Нитри́лы — органические соединения общей формулы R—C≡N, формально являющиеся C-замещенными производными синильной кислоты HC≡N

Капрон (поли-ε-капроамид, найлон-6, полиамид 6)— синтетическое полиамидное волокно, получаемое из нефти, продукт поликонденсации капролактама
[—HN(CH2)5CO—]n
В промышленности его получают путем полимеризации производного

Нейло́н (англ. nylon) — семейство синтетических полиамидов, используемых преимущественно в производстве волокон.
Наиболее распространены два вида нейлона: полигексаметиленадипинамид (анид (СССР/Россия), найлон 66 (США)), часто называемый собственно нейлоном и поли-ε-капроамид (капрон (СССР/Россия), найлон 6 (США)). Известны также другие виды, например, поли-ω-энантоамид (энант (СССР/Россия), найлон 7 (США)) и поли-ω-ундеканамид (ундекан (СССР/Россия), найлон 11 (США), рильсан (Франция, Италия)
Формула волокна из анида: [—HN(CH2)6NHOC(CH2)4CO—]n[1]. Анид синтезируется поликонденсацией адипиновой кислоты и гексаметилендиамина. Для обеспечения стехиометрического отношения реагентов 1:1, необходимого для получения полимера с максимальной молекулярной массой, используется соль адипиновой кислоты и гексаметилендиамина (АГ-соль):

R = (CH2)4, R' = (CH2)6
Формула волокна из капрона (найлона-6): [—HN(CH2)5CO—]n[1]. Синтез капрона из капролактама проводится гидролитической полимеризацией капролактама по механизму «раскрытие цикла — присоединение»:

Пластмассовые изделия могут изготавливаться из жёсткого нейлона — эколона, путём впрыскивания в форму жидкого нейлона под большим давлением, чем достигается бо́льшая плотность материала.
N47

Классификафия





N48




N49
КЕТОКИСЛОТЫ — органические вещества, в состав молекул которых входят карбоксильные (COOH—) и карбонильные (—CO—) группы; служат предшественниками многих соединений, выполняющих важные биологические функции в организме. Существенные нарушения обмена веществ, имеющие место при ряде патологических состояний, сопровождаются повышением концентрации в организме человека тех или иных кетокислот
кето енольная таутомерия


Методы получения Альфа и Бета кетокислот

α-Кетокислоты получают окислением α-гидроксикислот.
β-Кетокислоты ввиду своей неустойчивости получают из сложных эфиров конденсацией Кляйзена.
N50
В органической химии термин «реакция окисления» подразумевает, что окисляется именно органическое соединение, при этом окислителем в большинстве случаев является неорганический реагент.
Алкены
KMnO4 и H2O (нейтральная среда)
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение
KMnO4 и H+
(кислая среда)
идет разрыв двойной связи:
R-СH2=CH2-R + [O] → 2R-COOH — схематичное уравнение
Алкиларены
Эитлбензол- алкиларен


Кетоны
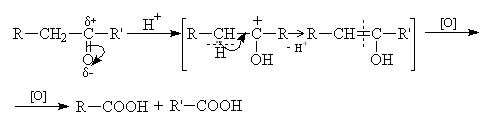
Кетоны к действию окислителей весьма устойчивы и окисляюся лишь сильными окислителями при нагревании. В процессе окисления происходит разрыв связей C-C по обе стороны карбонильной группы и в общем случае получается смесь четырех карбоновых кислот:

Окислению кетона предшествует его енолизация, которая может проходить как в щелочной, так и в кислой среде:

N51
Ви́нная кислота́ (диоксиянтарная кислота, тартаровая кислота, 2, 3-дигидроксибутандиовая кислота) НООС-СН(ОН)-СН(ОН)-СООН — двухосновная оксикислота. Соли и анионы винной кислоты называют тартратами.
Известны три стереоизомерные формы винной кислоты: D-(-)-энантиомер (слева вверху), L-(+)-энантиомер (справа вверху) и мезо -форма (мезовинная кислота):


Диастереомеры — стереоизомеры, не являющиеся зеркальными отражениями друг друга[1]. Диастереомерия возникает, когда соединение имеет несколько стереоцентров. Если два стереоизомера имеют противоположные конфигурации всех соответствующих стереоцентров, то они являются энантиомерами.
