Содержание серы в металле в количестве, превышающем допустимые нормы,
- отрицательно сказывается на его механических свойствах,
- служит причиной красноломкости металла,
- служит причиной появления в нем кристаллизационных (горячих) трещин.
Сера образует с железом сульфид железа FeS, температура плавления которого 1195 °С.
Сульфид железа почти не растворяется в твердом железе и выделяется в нем или в виде эвтектики или в виде отдельных включений разного вида и формы. Эвтектики могут быть двойные либо тройные, например:
FeS + Fe(Тпл = 985 °С); 2FeO • Si02 + FeS; FeS + Fe + MnS (Тпл = 980 °C) и др.
В процессе кристаллизации металла (рис. 130, б), протекающем в интервале температур ТЛ –Тс (ликвидус — солидус), эти сернистые эвтектики оттесняются растущими кристаллами металла шва к границам между ними и к месту стыка кристаллов в центральную часть сварочной ванны (на рис. 130, а — в затушеванную зону)
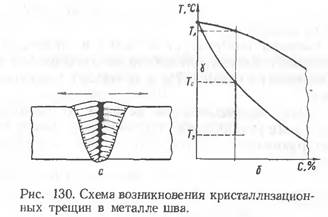
и становятся частью так называемых межкристаллитных прослоек. К моменту окончания кристаллизации металла шва такие межкристаллитные прослойки могут быть еще в жидком состоянии (Т3 — температура затвердевания сернистых эвтектик; Т3 < Тс).
Тогда возникновение заметных по величине растягивающих напряжений в шве (показаны стрелками на рис. 130, а) может вызвать появление на этих участках кристаллизационных, или горячих, трещин. Одновременное наличие в металле углерода и кремния увеличивает склонность швов к кристаллизационным трещинам.
Для более полного удаления серы из металла и благоприятного распределения оставшейся ее части в сварочную ванну нужно вводить такие элементы, которые имели бы к сере большее сродство, чем железо.
Образующиеся с этими элементами сульфиды должны обладать высокой температурой плавления и не создавать эвтектик. По степени возрастания прочности образующихся сульфидов их можно расположить в ряд, представленный в табл. 36.
|
|
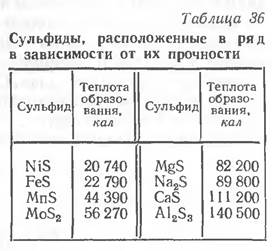
Как видим, наибольшим сродством к сере обладают Al, Са, Na, Mg. Однако использование их для связывания серы неудобно, так как все они имеют более высокое сродство к кислороду и связываются им в оксиды. Перечисленные элементы израсходуются на раскисление, а не на образование сульфидов.
Из числа элементов, приведенных в табл. 36, наибольший интерес с этой точки зрения представляет Мn по таким причинам:
1) он имеет сравнительно высокое сродство к сере;
2) как правило, всегда присутствует в стали в сравнительно больших количествах;
3) образует тугоплавкий сульфид, равномерно распределяющийся по всему объему металла;
4) при концентрациях в стали более 0,5—0,6% способствует переходу серы в шлак.

Согласно рис. 131, где показана зависимость состава сульфидной фазы [FeS]/[MnSj от концентрации марганца в малоуглеродистой стали, свидетельствуют о том, что марганец полезен главным образом как элемент, переводящий серу в более благоприятную форму существования в стали, тогда как его десульфурирующая способность относительно мала.
В сварочной практике связывают и удаляют серу чаще всего двумя способами: с помощью Мп и МпО, а также СаО.
Применение марганца
Сера образует с марганцем относительно прочный сульфид MnS с температурой плавления —1620 °С.
- Сульфид марганца слабо растворим в металле и хорошо — в шлаке; поэтому он в значительном количестве переходит в шлак.
|
|
- оставшийся в металле MnS распределяется в мелкодисперсном виде достаточно равномерно и не образует легкоплавких эвтектик.
Основной реакцией связывания серы марганцем является
[FeS] + [Mn] ↔ (MnS) + [Fe] (реакция 1)
с константой равновесия

Однако эффективность связывания серы в сульфид марганца по такой реакции мала, так как направо она заметно развивается лишь при пониженных температурах, когда скорости протекающих процессов весьма замедляются. [Mn] лучше работает при низких температурах. В итоге в металле шва оказываются значительные количества FeS.
Поэтому реакция дополняется второй:
[FeS] + (MnO) ↔ (MnS) + [FeO], (реакция 2)
для которой:
Для второй реакции константа равновесия Кс растет с увеличением температуры, т. е. с ростом температуры реакция сдвигается в сторону большего выхода (MnS) и [FeO ].
Рассматривая реакции совместно, можно отметить, что превращению FeS в MnS способствуют:
1) лучшая раскисленность металла (реакция 2 – образующийся [FeO] хорошо восстанавливается);
2) увеличение содержания марганца в металле (реакция 1);
3) высокая концентрация (МпО) в шлаке (реакция 2).
Обычно принимают отношение  в металле равным 20…25, что позволяет избежать кристаллизационных трещин.
в металле равным 20…25, что позволяет избежать кристаллизационных трещин.
Применение кальция
Кальций активно реагирует одновременно с серой и кислородом расплавленной стали. Даже при весьма низкой концентрации в металле (< 0,0001 %), кальций вследствие своей поверхностной активности оказывает заметное влияние на процесс рафинирования, особенно при совместном введении Са и присадок редкоземельных элементов — церия и лантана.
|
|
Связывание серы известью основано на образовании весьма прочного сульфида кальция, практически нерастворимого в металле. Процесс протекает в соответствии с реакцией
[FeS] + (CaO) ↔ (CaS) + [FeO].
Константа равновесия реакции растет с увеличением температуры, т. е. при этом процесс интенсивнее развивается вправо, в сторону образования (CaS).
Лучшее раскисление металла и введение в шлак окиси кальция будет способствовать уменьшению содержания [FeS] в металле.
Увеличение содержания (СаО) в шлаке приводит к росту константы распределения (S)/[S], что обеспечивает более полный переход серы из металла в шлак.