Комплексные соединения
Комплексные соединения классифицируются по природе лигандов или по характеру комплексных ионов.
Чаще комплексные соединения классифицируются по природе лиганда. Следуя этому принципу, можно выделить следующие группы комплексных соединений: аммиакаты и аминаты, аквакомплексы, ацидокомплексы, полигалогениды и др.
Аммиакаты – комплексы, содержащие во внутренней сфере в качестве лигандов молекулы аммиака. Их образуют почти все металлы.
Аммиакаты меди, серебра, никеля легко образуются при смешении растворов соответствующей соли и аммиака. При этом сначала образуется основная соль, которая затем растворяется вследствие процесса комплексообразования. Например:
2CuSO4 + 2NH4OH = (CuOH)2SO4↓ + (NH4)2SO4;
(CuOH)2SO4↓ + 8NH4OH = [Cu(NH3)4]SO4 + [Cu(NH3)4](OH)2 + 8H2O.
Аминаты – комплексные соединения, содержащие в качестве лиганда различные органические амины, чаще всего этилендиамин NH2 – CH2 – CH2 – NH2, который в комплексном соединении занимает обычно два координационных места. Таковы, например, соединения: [PtEn2]Cl2, [CoEn3]Cl3, [NiEn3]Br2, где En – молекула этилендиамина.
Аквакомплексы - комплексные соединения, в которых лигандами являются молекулы воды. При кристаллизации аквакомплексов образуются кристаллогидраты.
В кристаллогидратах молекулы воды обычно координированы вокруг катиона. Строение их не во всех случаях установлено, поэтому в химических формулах кристаллогидратов присоединение воды обычно указывают посредством точки: CrCl3∙6H2O, CuSO4∙5H2O, CoCl3∙6H2O, FeSO4∙7H2O, Na2CO3∙10H2O.
Ацидокомплексы - комплексные соединения, в которых лигандами являются кислотные остатки: K2[HgI4], Na2[PtCl6], K3[Ag(S2O3)2].
Ацидокомплексы можно представить и как сочетание солей, вследствие чего их также называют комплексными соединениями типа двойных солей: HgI2 ∙ 2KI, PtCl4 ∙ 2NaCl, Ag2S2O3 ∙ 3K2S2O3.
Существуют также комплексные соединения, во внутренней сфере которых имеются как молекулы воды, так и молекулы аммиака и кислотные остатки. Известны ряды комплексных соединений, в которых осуществляется постепенный переход от аммиакатов к аква – или ацидосоединениям, например: [Cr(NH3)6]3+, [Cr(NH3)5H2O]3+, [Cr(NH3)4(H2O)2]3+, [Cr(NH3)3(H2O)3]3+, [Cr(NH3)2(H2O)4]3+, [Cr(NH3)(H2O)5]3+, [Cr(H2O)6]3+.
В зависимости от характера комплексных ионов, комплексные соединения подразделяется на следующие группы:
а) катионные комплексы [Cu(NH3)4]Cl2, [Cr(H2O)6]Cl3;
б) анионные комплексы K3[Fe(CN)6], H2[SiF6];
в) катионно-анионные комплексы [Pt(NH3)4][PtCl4], [Co(NH3)6][Co(C2O4)3];
г) нейтральные комплексы (неэлектролиты) [Co(NH3)3(NO2)3]o, [Pt(NH3)2Br4]o.
Номенклатура комплексных соединений
Согласно современной номенклатуре первым в комплексном соединении называется анион в именительном падеже и только потом катион - в родительном падеже.
При названии комплексного иона прежде всего называют находящиеся во внутренней сфере анионы, прибавляя к их латинскому названию окончание "о", Например, хлоро(хлоридо), циано(цианидо), сульфито, OН- гидроксо и т.д.
Далее называют нейтральные лиганды. При этом пользуются терминами: для координированного аммиака - аммин, для воды - аква. Число лигандов указывают греческими числительными: 1 - моно (обычно не приводится),
2 - ди, 3 - три, 4 - тетра, 5 - пента, 6 - гекса. Затем переходят к названию центрального атома. Если центральный атом входит в состав комплексного катиона, то использует русское название элемента и в скобках указывают его степень окисления (римскими цифрами). Если центральный атом содержится в комплексном анионе, то употребляют латинское название комплексообразователя, после которого указывают его степень окисления, а в конце прибавляют суффикс – ат, например:
[Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV);
[Ag(NH3)2]Cl – хлорид диамминсеребра (I);
K2[HgI4] – тетраидомеркурат (II) калия или тетраиодогидраргират (II) калия;
(NH4)2[Pt(OH)2Cl4] – дигидроксотетрахлороплатинат (IV) аммония.
Те же принципы соблюдаются и при наименовании комплексных соединений, не являющихся электролитами. Например: [Pt(NH3)2Br4] – тетрабромодиамминплатина (IV).
Образец контрольной работы.
- а) Дайте названия комплексным соединениям: [Ni(NH3)6]Cl2, Na2[Zn(OH)4];
б) Составьте формулу комплексного соединения по его названию: гексацианоферрат (II) калия; гексатиоцианоферрат (III) калия.
Для (а) и (б) укажите центральный атом, лиганды, внутреннюю координационную сферу, внешнюю сферу. Напишите уравнения диссоциации этих соединений в водных растворах и выражения для констант нестойкости.
2.а) В каком растворе (при равной молярной концентрации), больше ионов Ag+ :
[Ag(NO2)2-; [Ag(NH3)2]+; [Ag(S2O3)2]3- . Константы нестойкости комплексных ионов соответственно равны 1,3 ∙ 10-3; 6,8 ∙ 10-8; 1,0 ∙ 10-13 . Напишите формулы соединений, содержащих эти ионы.
б) Константы нестойкости комплексных ионов: [Co(CN)4]2-; [Cd(CN)4]2-; [(Hg(CN)4]2- соответственно равны 8 × 10-20, 4 ×10-41 , 1,4 × 10-17. Какой из этих ионов является более прочным? Напишите формулы соединений, содержащих эти ионы.
3. а)В каком направлении будет протекать процесс и почему?
К2[HgI4] + 4KCN Û K2[Hg(CN)4] + 4KI
Kнест = 1,38 ×10-30 Kнест =6,03 ×10-10
б) Допишите уравнения реакций и установите, в каком направлении они будут протекать. Объясните почему.
[Cd(NH3)4]CI2 + KCN= K[Ag(CN)2] + K2S2O3 =
Kн ([Cd(NH3)4]2+) = 2,75∙10-7 Kн([Ag(CN)2]1-) = 1,0 × 10-21
Kн ([Cd(CN)4]2-) = 7,76∙10-18 Kн([Ag(S2O3)]1-) =1,0 ×10-18
Пример решения 1-го вопроса.
| Формула комплексного соединения и его название | Комплексо-образователь | Лиганд | Коорди-национ-ное число | Внутренняя сфера комплексного соединения | Ионы внешней сферы |
| [Ni(NH3)6]Cl2 хлорид гексаамминникеля (II) | Ni2+ | NH30 | [Ni(NH3)6]2+ | Cl- | |
| Na2[Zn(OH)4] тетрагидроксоцинкат натрия | Zn2+ | OH- | [Zn(OH)4]2- | Na+ | |
| гексацианоферрат (II) калия K4[Fe(CN)6] | Fe2+ | CN- | [Fe(CN)6]4- | K+ | |
| гексатиоцианоферрат (III) калия K3[Fe(SCN)6] | Fe3+ | SCN- | [Fe(SCN)6]3- | K+ |
Уравнения диссоциации и выражения для расчета константы нестойкости:
1) [Ni(NH3)6]Cl2 → [Ni(NH3)6]2+ + 2Cl-
[Ni(NH3)6]2+ ↔ Ni2+ + 6NH30
[Ni2+] ∙[ NH30 ] 6
Кнест. = ------------------------
[ [Ni(NH3)6]2+ ]
2) Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]2-
[Zn(OH)4]2- ↔ Zn2+ + 4OH-
[Zn2+] ∙[ OH-]4
Кнест. = ------------------------
[[Zn(OH)4]2- ]
3) K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-
[Fe(CN)6]4- ↔ Fe2+ + 6CN-
[Fe2+] ∙[CN-] 6
Кнест. = ------------------------
[[Fe(CN)6]4-]
4) K3[Fe(SCN)6] → 3K+ + [Fe(SCN)6]3-
[Fe(SCN)6]3- ↔ Fe3+ + 6 SCN-
[Fe3+] ∙[SCN-] 6
Кнест. = ------------------------
[[Fe(SCN)6]3-]
Решение типовых заданий
Пример 1. Назвать соединения, содержащих комплексные катионы или анионы:
a) K4[Fe(CN)6]; б) K3[Fe(CN)6]; в) Na2[Zn(OH)4]; г) [Ni(NH3)6]Cl2;
д) [Ag(NH3)2]OH; ж) [Cr(NH3)6] [CoIII(CN)6]; з) H3[Fe(PО4)2].
Решение.
а) гексацианоферрат (II) калия;
б) гексацианоферрат (III) калия;
в) тетрагидроксоцинкат натрия;
г) хлорид гексаамминникеля (II);
д) гидроксид диамминсеребра (I);
ж) гексацианокобальтат (Ш) гексаамминхрома (III);
з) диортофосфатоферрат (III) водорода.
Пример 2. Назвать соединения, не являющиеся электролитами:
а) [CoCl3(NH3)3]; б) [Ni(CO)4]; в) [PtCI2 (NH3)2].
Решение.
а) триамминтрихлорокобальт(II); б) тетракарбонилникель;
в) диаминдихлороплатина(II).
Пример 3. Вывести выражение общих констант нестойкости комплексных ионов. Сравнить устойчивость комплексов (значение констант нестойкости приведены в табл.
(см. приложение).
а) [Cd(NH3)4]2+; б) [CdJ4]2-; в) [Ni(NH3)6]2+; г)[Ni(CN)4]2-.
Решение.
Внимание. Сравнивать устойчивость комплексных ионов можно только для ионов, построенных однотипно. Можно сопоставлять устойчивость:
а) [Ag(NH3)2]+, [Ag(CN)2]-, [AgCl2]-, [AgBr2]-;
б) [Cu(NH3)4]2+, [Zn(NH3)4]2+.
Но нельзя сравнивать устойчивость этих двух групп ионов между собой.
а) [Cd(NH3)4]2+ ↔ Cd2+ + 4NH3,
 , Kнест1-4( [Cd(NH3)4]2+ )= 7,56∙10-13;
, Kнест1-4( [Cd(NH3)4]2+ )= 7,56∙10-13;
б) [CdJ4]2- ↔ Cd2+ + 4J-,
 , Kнест1-4 ([CdJ4]2-) = 8,00∙10-7;
, Kнест1-4 ([CdJ4]2-) = 8,00∙10-7;
в) [Ni(NH3)6]2+ ↔ Ni2+ + 6NH3,
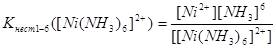 , Kнест1-6 ([Ni(NH3)6]2+) = 1,86∙10-9;
, Kнест1-6 ([Ni(NH3)6]2+) = 1,86∙10-9;
г) [Ni(CN)4]2+ ↔ Ni2+ + 4CN-,
 , Kнест1-4( [Ni(CN)4]2+) = 1,8∙10-14;
, Kнест1-4( [Ni(CN)4]2+) = 1,8∙10-14;
Для решения вопроса об устойчивости комплексных ионов сравнивают значение Kнест а, б и г, устойчивость уменьшается в ряду: г>а>б, сопоставлять устойчивость иона в с ионами а, б и г по этим данным невозможно.
Пример 4. Вычислить концентрацию ионов серебра в 0,1 М растворе [Ag(NH3)2]Cl содержащем в 1 л раствора 0,1 моль NH3.
Решение.
[Ag(NH3)2]+ ↔ Ag++2NH3,
Kнест 1-2 ( [Ag(NH3)2]+ ) =[Ag+][NH3]2/[[Ag(NH3)2]+],
C(Ag+)= Kнест 1-2 ( [Ag(NH3)2]+ )∙[[Ag(NH3)2]+]/[NH3]2 =9,3 ∙ 10-8∙(0,1)2/0,1=
9,3 • 10-7моль/л.
Ионизация комплексного иона [Ag(NH3)2]+ в растворе аммиака подавляется. Поэтому, как и в случае ионизации слабых электролитов, принимаем С[Ag(NH3)2]+ и C(NH3) равной их исходным концентрациям в растворе.Значение Kнест 1-2 ( [Ag(NH3)2]+) выбираем из таблицы (см.приложение).
Ответ: 9,3 • 10-7моль/л.
Пример 5. Возможно ли в стандартном состоянии:
а) замещение лигандов в динитроаргенат-ионе на цианид-ионы
б) центрального атома в тетрацианокобальтат(II)-ионе на катион кадмия.
Решение.
Ответить на поставленный вопрос можно, сравнив значения констант нестойкости данных комплексных ионов: замещение возможно, если вновь образующийся комплексный ион более прочный, т. е. значение константы нестойкости образующегося иона меньше.
а) динитроаргенат-ион: Kнест 1-2 ([Ag(NO2)2]- ) = 1,48 • 10-3
дицианоаргенат-ион: Kнест 1-2 ([Ag(CN)2]- ) = 1,41• 10-20.
Замещение возможно, т. к. Kнест 1-2 ([Ag(CN)2]- ) < Kнест 1-2 ([Ag(NO2)2]- ).
б) тетрацианокобальтат-ион: Kнест 1-4 ([Co(CN)4]2- ) = 8,13• 10-20
тетрацианокадмиат-ион: Kнест 1-4 ([Cd(CN)4]2- ) = 7,76• 10-18
Замещение невозможно, т. к. Kнест 1-4 ([Cd(CN)4]2- ) > Kнест 1-4 ([Co(CN)4]2- ).
Пример 6. В каком растворе (при равной молярной концентрации), больше ионов Ag+.
Константы нестойкости комплексных ионов: [Ag(NO2)2]1-; [Ag(NH3)2]+; [Ag(S2O3)2]3- соответственно равны 1,3 × 10-3; 6,8 × 10-8; 1,0 × 10-13 .
Решение.
Чем меньше значение константы нестойкости, тем меньше в растворе концентрация лигандов и комплексообразователя.
Больше ионов Ag+ в растворе, содержащем ионы [Ag(NO2)2]1-.
Пример 7. В каком направлении будет протекать процесс и почему?
К2[HgI4] + 4KCN Û K2[Hg(CN)4] + 4KI
Kнест= 1,38 ×10-30 Kнест=6,03 ×10-10
Решение.
Реакция всегда протекает в сторону образования более прочного соединения, у которого значение константы нестойкости меньше.
В данном случае процесс протекает влево (←).
Пример 8. Равновесие реакции:
[Zn(NH3)4](NO3)2 + 4KOH  K2[Zn(OH)4] + 2KNO3 + 4NH3↑
K2[Zn(OH)4] + 2KNO3 + 4NH3↑
смещено вправо. Какая из констант нестойкости больше:
а) К нест. [Zn(NH3)4] 2+ б) К нест [Zn(OH)4] 2-
Решение.
Чем меньше значение константы нестойкости, тем комплексное соединение более прочное, а реакция всегда протекает в сторону образования более прочного соединения.
В данном случае больше Кнест. [Zn(NH3)4] 2+.
Пример 9. При25°С Kнест 1-4 ([Cd(CN)4]2-) = 7,76• 10-18. Вычислите изменение энергии Гиббса процесса: [Cd(CN)4]2- ↔ Cd2+ + CN-.
Решение.
Величина изменение энергии Гиббса связана с величиной константы нестойкости соотношением: D Go = - 2,3RT∙lg Kнест.
D Go = - 2,3∙8,31∙298∙ lg7,66∙10-18 = 97,7 кДж/моль.
Пример 10. Какое из указанных веществ лучше выбрать для разрушения комплексного иона [Ag(CN)2]- (Kнест. = 1,0∙10-21)
а) Ag2CO3 (KS = 6,15∙10-12) б)Ag3PO4 (KS = 1,8∙10-18) в)Ag2S (KS = 5,7∙10-51)
Решение.
Комплексный ион разрушается, если образуется малорастворимое вещество, наиболее полно удаляющее ионы из раствора, т. е. имеющее наименьшее значение KS.
В данном случае это ответ: в) --- Ag2S.
Задания для самостоятельной работы
1. Написать координационные формулы следующих соединений:
тетрахлороаурат (III) калия, гексагидроксохромат (III) бария, хлорид нитритопентаамминхрома (III), гексафтороалюминат (III) натрия, тиоцианатотрицианокупрат (II) бария, дихлородиамминплатина, дисульфатоферрат (II) аммония, гексацианокобальтат (III) калия, гексацианоферрат (III) водорода, гексафторосиликат (IV) водорода, гидроксид гексаамминкобальта (П), пентакарбонилжелезо, тетратиоцианатогидраргират (II) калия, бромид цианотетраамминаквакобальта (III), хлорид гексааквахрома (III), гексацианоферрат (П) гексаамминникеля (II), дисульфатоферрат (II) аммония.
2. Написать координационную формулу комплексного соединения и назвать его, если: а) координационное число комплексообразователя равно четырем:
ZnCl2 ∙ 4NH3, Ni(CN)2 ∙2KCN, HgBr2 ∙ 2KBr, BiI3 ∙ KI,
PtCl2 ∙ 2NH3, Pb(OH)2 ∙ 2KOH, PdCI2 ∙ 2KC1, BF3 ∙ KF, Cd(C104)2 ∙ 4NH3;
б) координационное число комплексообразователя равно шести:
CrCl3 ∙ 5Н20, PtCI4 ∙ 2NH3, Co(N03)2 ∙ 5NH3, CoCl3 ∙ 5NH,NiCl2 ∙ 6NH3, CoCl3∙ ∙ 4NH3, Pt(OH)4 ∙ KOH ∙ KCl, CoCl3 ∙ 5NH3 ∙ H20, CrCI3 ∙ 3H20 ∙ 3NH3, Cr(SCN)3 ∙ 3KSCN,
Co(SCN)3 ∙ NH4SCN ∙ 2NH3, PtCl ∙ 5NH3, Co(NO2)3 ∙3KNO2.
3. Написать уравнение реакции Zn(OH)2 с аммиаком.
Координационное число равно 4.
4. Написать уравнение ионизации в растворах следующих координационных соединений и выражения для ступенчатых констант нестойкости и общей константы нестойкости:
[Zn(NH3)4]2+,[Au(Cl)4]2-,[Cu(NH3)4]SО4, K2[PtCl4].
5. Изменение энергии Гиббса для процесса: [Cu(CN)2]- ↔ Cu- + CN-
при 25°С равно 137 кДж/моль. Вычислите Kнест этого комплексного иона.
6. Написать уравнения возможных реакций образования новых комплексных соединений в молекулярном и ионном виде (необходимые значения константы нестойкости приведены в таблице приложения).
[Cd(NH3)4]CI2 + KCN= Na [ AuBr2] + NaCN =
K2[Hg(SCN)4] + KI = K2[CdCl4] + NH3 • H2О =
К [Cu(CN)2] + KI= [Ag(NH3)2]Cl+Na2S2О3=
7. В каком направлении будут протекать процессы и почему?
[Ag(NH3)2]NO3 + K2S2O3 Û K[Ag(S2O3)] + KNO3 + 2NH3
Kн=5,89×10-9 Кн=1,0×10-18
8. В каком направлении будет протекать процесс и почему?
K[Ag(CN)2] + K2S2O3 Û K[Ag(S2O3)] + 2KCN
Kн = 1,0 × 10-21 Kн =1,0 ×10-18
9. Равновесие реакции
[Cd(NH3)4]SO4 + 4KCN  K2[Cd(CN)4] + K2SO4 + 4NH3↑
K2[Cd(CN)4] + K2SO4 + 4NH3↑
смещено вправо. Какая из констант нестойкости меньше:
а) К нест. [Cd(NH3)4]2+ б) К нест [Cd(CN)4]2-
10. Объяснить, почему разрушается комплексный ион при обработке комплексного соединения [Ni(NH3)6]Cl2:
а) HNO2; б) K2S: в) KCN.
11. Гидроксид меди (II) растворяется, а сульфид меди (II) не растворяется в концентрированном растворе аммиака. Объяснить наблюдаемое явление.
12. Константы нестойкости комплексных ионов [Co(CN)4]2-, [Hg(CN)4]2-, [Cd(CN)4]2- соответственно равны 8 × 10-20 ; 4 × 10-41 ; 1,4 ×10-17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов СN- больше? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы
13. Константы нестойкости комплексных ионов: [Co(CN)4]2-; [Cd(CN)4]2-; [(Hg(CN)4]2- соответственно равны 8 × 10-20, 4 ×10-41 , 1,4 × 10-17. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
14. Возможно ли в стандартном состоянии замещение:
- лиганда в гексафтороферрат (Ш)-ионе на тиоцианат-ион;
-иона-комплексообразователя в тетрацианокадмиат-ионе на катион никеля(II).
15. Рассчитать концентращпо лигандов в 0,02 М растворах комплексных соединений: a) K[Au(CN)2]; б) [Cu(NH3)2]Cl; в) Na3[Ag(S203)2]
Ответ: а) 5,85 • 1044моль/л; б) 9,64 • 10 4 моль/л в) 1,0 • 10-5 моль/л.
16. Рассчитать концентрацию лиганда в 0,05 М растворе K[Ag(CN)], содержащем 0,1 моль AgNO3 в I л этого раствора Ответ: 2,0 – 10-11 моль/л.
17. К 0,1М раствору K2[Cu(СN)4], содержащему, кроме того 0,1 моль/л KCN, прибавлен раствор сульфида натрия. Рассчитать концентрацию сульфид-ионов, при которой сульфид кадмия может выпасть в осадок. Произведение растворимости сульфида кадмия равно 3,6·10-29.
ПРИЛОЖЕНИЕ
Общие константы нестойкости комплексных ионов
| Лиганд-аммиак, NH3 | ||
| Ag+ K1-2=5,89·10-8 | Co2+ K1-6=4,07·10-5 | Hg2+ K1-4=5,01·10-20 |
| Cd2+ K1-4=2,75·10-7 | Co3+ K1-6=6,17·10-36 | Ni2+ K1-4=3,39·10-8 |
| Co2+ K1-4=8,51·10-6 | Cu2+ K1-4=1,07·10-12 | Zn2+ K1-4=8,32·10-10 |
| Лиганд-иодид-ион, I- | ||
| Bi3+ K1-6=7,94·10-20 | Hg2+ K1-4=1,48·10-30 | Pb2+ K1-4=1,20·10-4 |
| Лиганд-цианид-ион, CN- | ||
| Ag+ K1-2=1,41·10-20 | Co3+ K1-6=1,0·10-64 | Fe3+ K1-6=1,26·10-44 |
| Au+ K1-2=5,01·10-30 | Cu+ K1-4=2,0·10-30 | Ni2+ K1-4=1,0·10-31 |
| Cd2+ K1-4=7,76·10-18 | Fe2+ K1-4=1,26·10-37 | Zn2+ K1-4=2,40·10-20 |
| Co2+ K1-6=8,13·10-20 | ||
| Лиганд-фторид-ион, F- | ||
| Al3+ K1-6=2,14·10-21 | Fe3+ K1-6=7,94·10-17 | |
| Лиганд-тиоцианат-ион, SCN- | ||
| Ag+ K1-2=5,89·10-9 | Co2+ K1-3=1,58·10-2 | Fe3+ K1-6=5,89·10-4 |
| Bi3+ K1-6=5,89·10-5 | Cu2+ K1-4=3,02·10-7 | Hg2+ K1-4=6,31·10-22 |
| Лиганд-тартрат-ион, -OOC–CH(OH)–CH(OH)–COO- | ||
| Co2+ K1-2=9,77·10-10 | Fe3+ K1-2=1,38·10-12 | |
| Лиганд- нитрит-ион,NO-2 | ||
| Ag+ K1-2=1,48·10-3 | Cd2+ K1-3=1,55·10-4 | |
| Лиганд- бромид-ион,Br- | ||
| Bi 3+ K1-6=3,02·10-10 | Hg2+ K1-4=1·10-21 | Pt2+ K1-4 = 3,16·10-21 |
| Лиганд- хлорид-ион,Cl- | ||
| Bi3+ K1-6=3,80·10-7 | Pt2+ K1-4=1,0·10-16 | |
| Лиганд- ЭДТА,(-COO-CH2)2N-(CH2)2-N(CH2-COO-)2 | ||
| Комплексы состава 1: 1 | ||
| Al3+ 3,16·10-17 | Co3+ 2,51·10-41 | Mg2+ 7,59·10-10 |
| Ba2+ 1,66·10-8 | Cr3+ 3,98·10-21 | Mn2+ 9,12·10-15 |
| Bi3+ 3,98·10-28 | Cu2+ 1,58·10-19 | Pb2+ 9,12·10-19 |
| Ca2+ 2,57·10-11 | Fe2+ 6,31·10-15 | Tl+ 2,95·10-7 |
| Cd2+ 3,47·10-17 | Fe3+ 5,89·10-25 | Tl3+ 1,58·10-38 |
| Co2+ 4,90·10-17 | Hg2+ 1,58·10-22 | Zn2+ 5,50·10-17 |