1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, принадлежащими двум атомам.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
3. Характеристики химической связи определяются типом перекрывания АО.
4. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
σ– связь может возникать при перекрывании s - орбиталей, s - и р - орбиталей, р - орбиталей, d - орбиталей а также d - и s - орбиталей, d - и р – орбиталей. σ– связь обычно объединяет два атома, поэтому является локализованной двуцентровой связью. При образовании  -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
8.Ионная связь, как крайний случай поляризации ковалентной связи. Ненарпавленность и ненасыщенность ионной связи. Ионная химическая связь(Ме и неМе) возникает при электростатическом взаимодействии отрицательно и положительно заряженных ионов в химическом соединении. Эта связь возникает лишь в случае большой разности ЭО атомов, например, между катионами s - металлов первой и второй групп периодической системы и анионами неметаллов шестой и седьмой групп (LiF, СsСl, NaCl и др.) Так как ион может притягивать к себе ионы противоположного знака в любом направлении, ионная связь в отличие от ковалентной отличается ненаправленностью. Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому они могут притягивать и другие ионы противоположного знака, то есть ионная связь отличается ненасыщенностью.
9. Гибридизация атомныхорбиталей. Типы гибридизации и структура молекул. Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Тип гибридизации Геометрическая форма Угол между связями Пример
sp линейная 180o BeCl2
sp 2 треугольная 120o BCl3
sp 3 тетраэдрическая 109,5o CH4
10. Полярная и неполярная ковалентная связь. Полярность молекул.Электрический момент диполя. Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода:  (на схеме электроны обозначены точками).
(на схеме электроны обозначены точками).
Ковалентная полярная связь образуется между атомами различных неметаллов. Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
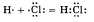 Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд 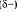 , а на атоме водорода — частичный положительный
, а на атоме водорода — частичный положительный  . Таким образом, молекула становится полярной: Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.В симметричных по форме молекулах (например, BF3) "центры тяжести" отрицательного (δ−) и положительного (δ+) зарядов совпадают, а в несимметричных молекулах (например, NH3) - не совпадает. Вследствие этого в несимметричных молекулах образуется электрический диполь - разнесённые на некоторое расстояние в пространстве разноименные заряды. Полярные молекулы -диполи, системы, состоящие из двух равных по величине и противоположных по знаку заряду находящиеся расстоянии L.
. Таким образом, молекула становится полярной: Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.В симметричных по форме молекулах (например, BF3) "центры тяжести" отрицательного (δ−) и положительного (δ+) зарядов совпадают, а в несимметричных молекулах (например, NH3) - не совпадает. Вследствие этого в несимметричных молекулах образуется электрический диполь - разнесённые на некоторое расстояние в пространстве разноименные заряды. Полярные молекулы -диполи, системы, состоящие из двух равных по величине и противоположных по знаку заряду находящиеся расстоянии L.
11. Метод валентных связей для объединения химической связи в комплексные соединения. Магнитные свойства комплексных ионов. В методе валентных связей предполагается, что атомы в молекуле охраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. При сближении двух атомов водорода с антипараллельными спинами происходит уменьшение энергии системы, что обусловлено увеличением электронной плотности в пространстве между ядрами взаимодействующих атомов. Основные положения:1)Хим. связь между двумя атомами возникает как результат перекрывания атомных орбиталей с образованием электронных пар(обобщение двух электронов).2) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами(энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц.3) в соответствии с принципом Паули(в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом) химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами.4) характеристики химической связи(энергия, длина, полярность) определяются типом перекрывания атомных орбиталей. Парамагнитные комплексы обладают моментом µ и поэтому при взаимодействии с внешним магнитным полем втягиваются в него. Напротив, диамагнитные комплексы, не имея собственного магнитного момента, выталкиваются из внешнего магнитного поля. Парамагнитные свойства веществ обусловлены наличием в их структуре неспаренных электронов и в случае комплексов объясняются специфическим заполнением электронами энергетических уровней. Существуют два принципа, определяющих заполнение электронами d-орбиталей, расщепленных на dε и dγ -подуровни.1. Электроны заполняют орбитали так, чтобы число неспаренных электронов было максимальным (правило Хунда).2. Сначала заполняются орбитали, имеющие меньшую энергию.
12. межмолекулярное взаимодействие. Водородная связь. Влияние водородной связи на свойство вещества. Донорно- акцепторное взаимодействие. Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Межмолекулярное взаимодействие зависит от расстояния r между молекулами и, как правило, описывается потенциальной энергией взаимодействия.дисперсионным потому, что дисперсия света в веществе определяется теми же свойствами молекул, что и это взаимодействие. Ориентационное взаимодействие Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение. Индукционное взаимодействие Если рядом с полярная молекула окажется полярная рядом снеполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы.  Водородная связь возникает между молекулами, в которых атом H связан с атомами других элементов, обладающего высокой электороотрицательностью. При возникновении водородных связей образуются димеры, тримеры(HF)n,кольцевые структуры некоторых органических кислот, например уксусной кислоты или более сложные конфигурации льда, у которого молекулы воды образуют по 4 водородные связи. Образование межмолекулярных водородных связей приводит к повышению вязкости, диэлектрической постоянной, температуры кипения и плавления, теплоты парообразования. Под влиянием водородных связей изменяются химические свойства. HF – слабая кислота, а HCl- сильная кислота если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой не поделённых электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи(NH3BF3)
Водородная связь возникает между молекулами, в которых атом H связан с атомами других элементов, обладающего высокой электороотрицательностью. При возникновении водородных связей образуются димеры, тримеры(HF)n,кольцевые структуры некоторых органических кислот, например уксусной кислоты или более сложные конфигурации льда, у которого молекулы воды образуют по 4 водородные связи. Образование межмолекулярных водородных связей приводит к повышению вязкости, диэлектрической постоянной, температуры кипения и плавления, теплоты парообразования. Под влиянием водородных связей изменяются химические свойства. HF – слабая кислота, а HCl- сильная кислота если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой не поделённых электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи(NH3BF3)
13. Типы кристаллических решеток, их влияние на свойство вещества. В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллических решеток: Ионные, металические, атомные и молекулярные. Кристаллические решетки, состоящие из ионов называются ионными(NaCl).кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Они соединены прочными ковалентными связями(алмаз) все вещества с атомной кристаллической решеткой имеют высокие температуры плавления, прочны и тверды, практически нерастворимы в жидкостях. Атомная кристаллическая решетка характерна для твердого брома, кремния, германия. Кристаллические решетки, состоящие из молекул, называются молекулярными. Такие вещества имеют малую твердость и низкие температуры плавление, нерастворимы или малорастворимые в воде, их растворы почти не проводят электрический ток. Примеры: лед, сухой лёд, твердые галогеноводороды, благородные газы.в твердом и жидком состоянии металлы образуют металлические кристаллические решетки. Процесс образования металлического кристалла протекает с выделением энергии. Электроны, осуществляющие металлическую связь свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Вещества с металлической связью пластичны, есть металлический блеск, серый цвет, непрозрачность, электропроводимость.
14.Скорость реакции в гомогенной системе. Факторы, влияющие на скорость реакции. Константа скорости реакции. Закон действия масс.Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
H2SO4+Na2S2O3= Na2SO4+Н2O+SO2+S¯
Условия, влияющие на скорость химической реакции:1) природа реагирующих веществ2) температура- при повышении температуры реакции на каждые 10 0 скорость реакции возрастает в 2-4 раза. 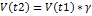 t2-t1/10/ . 3)концентрация реагирующих веществ- при увеличении концентраций вещества увеличивается число реагирующих веществ.
t2-t1/10/ . 3)концентрация реагирующих веществ- при увеличении концентраций вещества увеличивается число реагирующих веществ.  - закон действующих масс.4)Действие катализаторов. Ингибиторы- вещества, замедляющие реакцию, но не участвующие в ней.5) поверхность соприкосновения реагирующих веществ- увеличение площади поверхности ведет к увеличению скорости реакции.
- закон действующих масс.4)Действие катализаторов. Ингибиторы- вещества, замедляющие реакцию, но не участвующие в ней.5) поверхность соприкосновения реагирующих веществ- увеличение площади поверхности ведет к увеличению скорости реакции. 
где k1 — константа скорости прямой реакции, а k2 — обратной. Это важное соотношение даёт одну из «точек соприкосновения» химической кинетики и химической термодинамики. Скорость любого гетерогенного процесса возрастает при увеличении поверхности контакта фаз. Для этого используют измельчение твердой фазы. Гетерогенные реакции имеют большое значение в технике (горение твердого топлива, коррозия металлов и т.д.). Любые гетерогенные процессы связаны с переносом вещества, и в них можно выделить три стадии:1) Подвод реагирующего вещества к поверхности.2) Химическая реакция на поверхности.3) Отвод продукта реакции от поверхности.
15. Энергия активации. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации- энергия, необходимая для преодоления энергетического барьера. Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза  где v 2 и v 1 - скорости реакции при температурах Т 2 и Т 1, γ - коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2 – 4.При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Правило Вант – Гоффа запишется так:
где v 2 и v 1 - скорости реакции при температурах Т 2 и Т 1, γ - коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2 – 4.При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Правило Вант – Гоффа запишется так:  Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.Эти два уравнения можно использовать лишь для ориентировочных расчетов, так как точность их не очень высока.
Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.Эти два уравнения можно использовать лишь для ориентировочных расчетов, так как точность их не очень высока.
16. катализ гомогенной, гетерогенной, ферментативный. Понятие о мехпнизме каталитических процессов. Гомогенный катализ- катализатор и реагенты находятся в одной фазе и процесс протекает о всем объеме.2H2O2 + K2Cr2O7=2H2O+O2 Гетерогенный катализ- катализатор и реагент находятся в разных фазах и процесс протекает на поверхности их раздела. 2H2O+MnO2=2H2O+O2; C2H4(г)+H2(г)+Ni=C2H6(г)ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ), ускорение биохим. р-ций при участии белковых макромолекул, называемых ферментами. 2H2O2(Катализатор)= 2H2O+O2. механизма катализа: Кислотно-основной катализ относится к очень распространенному и к наиболее изученному типу катализа. В катализе протонными кислотами Бренстеда (НА) субстрат реакции (реагент) выступает в качестве основания и первой стадией является протонирование реагента. Протонированный реагент (B) переходит в более реакционно-способное состояние и превращается далее через одно или несколько промежуточных соединений.
17. Обратимые и необратимые процессы. Химическое равновесие. Константа равновесия. Обратимый процесс допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежут. состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой.
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и др. Для хим. р-ции применяют понятия термодинамич. и кинетич. обратимости, к-рые совпадают только в непосредств. близости к состоянию равновесия. Р-ция А + В 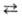 С + D наз. кинетически обратимой или двусторонней, если в данных условиях продукты С и D могут реагировать друг с другом с образованием исходных в-в А и В. При этом скорости прямой и обратной р-ций, соотв.
С + D наз. кинетически обратимой или двусторонней, если в данных условиях продукты С и D могут реагировать друг с другом с образованием исходных в-в А и В. При этом скорости прямой и обратной р-ций, соотв. 
 , где
, где  и
и  -константы скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением времени становятся равными и наступает химическое равновесие, в к-ром
-константы скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением времени становятся равными и наступает химическое равновесие, в к-ром  -константа равновесия., зависящая от т-ры. Кинетически необратимыми (односторонними) являются обычно такие р-ции, в ходе к-рых хотя бы один из продуктов удаляется из зоны р-ции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированногосоед.), а также р-ции, сопровождающиеся выделением большого кол-ва тепла.
-константа равновесия., зависящая от т-ры. Кинетически необратимыми (односторонними) являются обычно такие р-ции, в ходе к-рых хотя бы один из продуктов удаляется из зоны р-ции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированногосоед.), а также р-ции, сопровождающиеся выделением большого кол-ва тепла.
На практике нередко встречаются системы, находящиеся в частичном равновесии, т.е. в равновесии по отношению копределенного рода процессам, тогда как в целом система неравновесна. Напр., образец закаленной стали обладает пространств.неоднородностью и является системой, неравновесной по отношению к диффузионным процессам, однако в этом образце могут происходить равновесные циклы мех. деформации, поскольку времена релаксации диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно, процессы с относительно большим временем релаксации являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.Необратимые процессы сопровождаются диссипатив-ными эффектами, сущностью к-рых является производство (генерирование) энтропии в системе в результате протекания рассматриваемого процесса. Простейшее выражениезакона диссипации имеет вид:
 где
где  средняя т-ра, diS- производство энтропии,
средняя т-ра, diS- производство энтропии,  - т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).Обратимые процессы, будучи идеализированными, не сопровождаются диссипативными эффектами. Микроско-пич. теория О. и н. п. развивается в статистической термодинамике. Системы, в к-рых протекают необратимые процессы, изучает термодинамика необратимых процессов. Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При
- т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).Обратимые процессы, будучи идеализированными, не сопровождаются диссипативными эффектами. Микроско-пич. теория О. и н. п. развивается в статистической термодинамике. Системы, в к-рых протекают необратимые процессы, изучает термодинамика необратимых процессов. Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При
химическом равновесии концентрации веществ остаются неизменными. Химическое
равновесие имеет динамический характер: прямая и обратная реакции при
равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой
равновесия, представляющей собой отношение констант прямой (K1) и
обратной (K2) реакций.
Для реакции mA + nB «pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ.
Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону
образования продуктов прямой реакции.
18. Смещение химическое равновесия. Принцип Ле-Шателье. Влияние температуры, давления и концентрации реагентов на равновесие.Принцип Ле-Шателье. Если на систему, находящуюся в равновесии,производится внешнее воздействие (изменяются концентрация, температура,давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие.Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. Принцип ЛеШателье — Брауна (1884 г.) — если на систему, находящуюся в состоянии химического равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то равновесие сместится в том направлении, в котором оказанное воздействие будет ослаблено. Факторы влияющие на химическое равновесие: температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Qt↑ ←, t↓ → 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.CaCO3=CaO+CO2 P↑ ←, P↓ →1моль=1моль+1моль 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции-в сторону исходных веществ.S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ← Катализаторы не влияют на смещение химического равновесия!
19.Растворы как многокомпонентные системы. Гидратная теория растворов Менделеева. Различные способы выражения концентрации растворов. Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ ипродуктов их взаимодействия. По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов). Размеры частиц в истинных растворах - менее 10-9 м (порядка размеров молекул).Если молекулярные или ионные частицы, распределённые в жидком растворе присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г H2O, то при 200C растворится только 36 г соли). Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Поместив в 100 г воды при 200C меньше 36 г NaCl получим ненасыщенный раствор. При нагревании смеси соли с водой до 1000C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора не растворившуюся соль, а раствор осторожно охладить до 200C, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором (очень неустойчивы). Менделеев считал, что существует связь между растворяющимся веществом и растворителем, этот процесс называется сольватацией, а полученные вещества-сольваты. С водой процесс называется – гидротацией, а получившиеся вещества - гидраты. Проиллюстрируем это на примере растворения NaCl в воде. Между ионами натрия и хлора в кристалле существует ионная связь. При погружении кристалла NaCl в воду ионы поверзн слоя взаимод с полярными молекулами воды – диполями. Возникает иондипольное взаимодействие, которое сильнее чем ионная связь и разрывает связи в кристалле. Гидратированные ионы отрываются от кристалла, полностью окруж-ся диполями воды. Постепенно весь кристалл распадается на отдельные гидратные ионы, образую с водой гомогенную систему – истинный раствор. Число молекул воды, связанных с ионами раствор вещ-ва, зависит от его природы и размеров. Гидротир ионы и молекулы иногда настолько прочны, что при выделение раствор вещества из растворителя (выпариванием) выпадают кристаллы содержащие молекулы воды, эти вещества называют кристаллогидраты. при растворении происходит 1)разрушение хим и межмолек связей в растворителях – эндотермич процесс 2)образование сольватов сопровожд выделением энергии – экзотерм процесс 3)распределение сольватов в растворителе, связанное с диффузией – эндотермич процесс – эндотермич процесс. Суммарный тепловой эффект процесс ÑH может быть <>0. При растворении газов и большенства жидкостей энергия, затраченная на разрыв межмолек связей невелика и процесс растворения экзотермический. При раствор уксусной кислоты теплота поглощается, т.к. между молекулами сущ-етводородная связь. Прираствортв вещ-в с прочной кристал структурой разрушение решетки требует значительной затраты энергии и процесс эндотермический (NaNO3, NH4NO3), но теплота выделяется при растворении (NaOH, KOH). Процентной концентрацией раствора (С) называется массовая доля растворённого вещества в растворе (W), выраженная в %: С% = W% (растворённого вещества) = (m растворённого вещества• 100%) /m раствора Процентная концентрация показывает, сколько единиц массы (г, кг) растворённого вещества содержится в каждых 100 единицах массы (г, кг) раствора При смешивании двух различных растворов, массовую долю растворённого вещества во вновь полученном растворе определяют по правилу смешения: m1/m2 = (W3-W2)/(W1-W3) Молярную концентрацию (Cm) растворов определяют по формуле: Cm = υ растворённого вещества / V раствор , где ν = m/M - количество вещества (здесь М - молярная масса вещества), V – объём Cm измеряют в моль/л или моль/м3 (в системе СИ). Молярная концентрация показывает количество растворённого вещества (моль), содержащегося в 1л раствора.
20. Электролитическа диссоциация. Зависимость диссоциации от характера связей в молекулах электролитов. Соли, кислоты, основания. Согласно теории электролитической диссоциации, соли, кислоты, гидроксиды, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы.Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией. Вещества, диссоциирующие на ионы в растворах, называют электролитами. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами; к ним относятся, например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы. Кислоты - это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют: H2SO4 = 2H+ + SO42−, HF  H+ + F−
H+ + F−
| Сильные кислоты | HCl, HBr, HI, HClO4, H2SO4, H2SeO4, HNO3, HMnO4, H2Cr2O7 ит.п. |
| Слабые кислоты | HF, H2S, HCN, HClO, HNO2, H3PO4, H2CO3, CH3COOH, H4SiO4 идругие |
Основания - это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют:KOH = K+ + OH−,
Ca(OH)2 = Ca2+ + 2OH− Диссоциация малорастворимых оснований Mg(OH)2, Cu(OH)2, Mn(OH)2, Fe(OH)2 и других практического значения не имеет.К сильным основаниям (щелочам) относятся NaOH, KOH, Ba(OH)2 и некоторые другие. Самым известным слабым основанием является гидрат аммиака NH3 · H2O. Соли - это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н+ и любые анионы, кроме OH−:
· CuSO4 = Cu2+ + SO42−
· BaCl2 = Ba2+ + 2Cl−
· KHCO3 = K+ + HCO3−
· NaHS = Na+ + HS−
· KAl(SO4)2 = K+ + Al3+ + 2SO42−
После растворения и диссоциации средних и кислых солей их катионы и/или анионы могут далее взаимодействовать с водой - подвергаться обратимому гидролизу; за счет последнего процесса в растворах многих солей появляются катионы Н+ и/или анионы OH−. Оснóвные соли MgCl(OH), Cu2CO3(OH)2 и другие в своем большинстве практически нерастворимы в воде. Нейтральная, кислотная и щелочная среда. Чистая вода - это очень слабый электролит:
H2O  H+ + OH−
H+ + OH−
Концентрации катионов водорода H+ и гидроксид-ионов OH− в чистой воде весьма невелики и составляют 1 · 10−7 моль/л при 25 °С. Катион водорода H+ представляет собой простейшую химическую частицу - протон p + (электронная оболочка катиона H+ отвечает формуле 1 s 0 и не содержит электронов). У свободного протона велики подвижность и проникающая способность; в окружении полярных молекул воды он не может оставаться свободным и присоединяется к одной из молекул H2O, образуя катион оксония H3O+:H2O + H+ = H3O+В дальнейшем для упрощения записываем только H+, но подразумеваем H3O+. В чистой воде содержание H3O+ (H+) и OH− одинаково; в водных растворах кислот появляется избыток ионов H3O+ (H+), а в щелочных - избыток ионов OH за счет диссоциации кислот или оснований). Типы среды водных растворов:
· Нейтральная - c (H+) = c (OH−)
· Кислотная - c (H+) > c (OH−)
· Щелочная - c (H+) < c (OH−)