Чаще всего в растворе лишь часть электролита диссоциирует на ионы, поэтому существует понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.В связи с этим электролиты можно разделить на две группы - сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически полностью. Понятие степени диссоциации к ним не применимо. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.К сильным электролитам принадлежат почти все соли; из кислот и оснований к ним относятся HNO3, HCIO4, НСI, HBr, HI, КОН, NaOH, Ba(OH)2 и Са(ОН)2.К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат Н2СО3, H2S, HCN, H2SiО3и NH4OH.Степень диссоциации принято обозначать греческой буквой ά и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора СН3СООН ά = 0,013 (или 1,3%), а для 0,1 н. раствора HCN ά = 10ˉ4 (или 0,01%). Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в
водном растворе на ионы. Константа диссоциации обычно обозначается  и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
 где комплекс
где комплекс  разбивается на x единиц A и y единиц B,
разбивается на x единиц A и y единиц B,
константа диссоциации определяется так:
 где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Степень диссоциации α изменяется с концентрацией раствора. Рассмотрим зависимость степень диссоциации от концентрации слабого электролита на примере уксусной кислоты.
CH3COOH ↔ CH3COO + H. Принимая исходную концентрацию кислоты равной c, а степень диссоциации α, получаем, что концентрация части кислоты, которая диссоциирована, будет равна αc. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна c — αс = c(1 — α). Подставив значения равновесных концентраций ионов и кислоты в уравнение константы диссоциации, получим: Кд = (α²c²)/c(1 — α) = (α²c)/(1-α) = α²/(1-α)V, где V = 1/c. Это уравнение было получено Освальдом и называется законом Освальда. Если α << 1, то уравнение упрощается: Кд ≈ α²c и α≈√Кд/c. Это уравнение называется законом разбавления Освальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита
23. Малорастворимые вещества. Произведение растворимости. Условие осаждения малорастворимого электролита. Переосаждение. Малорастворимые вещества - вещества, растворимость которых в воде лежит в пределах от 0,01 до 1 г на 100 г воды. Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:

Константа этого равновесия рассчитывается по уравнению:
 В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:

Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
 где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.Условием образования осадка является превышение произведения конц-ций ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка, концентрация другого осадка конц-ция другого иона вход-го в состав электролита, тоже изменяется. Устанавливается новое равновесие. при котором ПР концентрации ионов электролита вновь становится равным ПР. Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав, его каким-либо другим ионом), произведение конц-ций ионов будет меньше значения ПР, раствор станет ненасыщенным, а равновесие между жидкой фазой и осадком сместится в сторону растворения осадка.=> растворение осадка малорастворимого электролита происходит при условии, что произведение конц-ций его ионов меньше значения ПР.При добавлении к концентрированному раствору вещества растворителя, в котором вещество плохо растворимо, происходит быстрое выпадение осадка, который, однако, часто значительно загрязнен примесями (см. Быстрая или медленная кристаллизация), которые к тому же могут вызвать выпадение вещества в виде масла.Метод используется для выделения растворенных веществ, выпадение которых не происходит ни при растирании стеклянной палочкой, ни при охлаждении. Пример 1#: Выделение вещества из ДМСО или ДМФА (растворители с высокими температурами кипения, испарить их очень сложно) при добавлении воды. Пример 2#: Выделение вещества из этилацетата при добавлении гексана или из спиртов при добавлении эфира.
24. Электролитическая ионизация воды. Водородный показатель рН. Индикаторы. Понятие о буферных растворах. Для реакции диссоциации воды HOH ↔ H+ + OH– константа равновесия определяется следующим уравнением: К = [H+] [OH–] / [H2O]. Концентрация воды в водных растворах практически не меняется и вводится в константу равновесия (Кw).
Кw =[H+][OH–]= К [H2O].Полученную константу (Кw) для воды называют ионным произведением воды,которое зависит только от температуры (Кw = 10–14). При диссоциации воды на каждый ион Н+ образуется один ион ОН–. Следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–]. Используя значение ионного произведения воды, находим [Н+] = [ОН–] =  моль/л. Таковы концентрации ионов Н+ и ОН– в чистой воде. При добавлении соляной кислоты, которая диссоциирует в воде на ионы Н+ и Сl–, концентрация ионов Н+ в растворе увеличится, но ионное произведение воды от концентрации не зависит – в таком случае уменьшается концентрация [ОН–]. Напротив, если к воде добавить щелочь, то концентрация [ОН–] увеличится, а [Н+] уменьшится. Концентрации [Н+] и [ОН–] взаимосвязаны: чем больше одна величина,тем меньше другая, и наоборот. Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10–7 моль/л, в нейтральных [Н+] = 10–7моль/л, в щелочных [Н+] < 10–7 моль/л.
моль/л. Таковы концентрации ионов Н+ и ОН– в чистой воде. При добавлении соляной кислоты, которая диссоциирует в воде на ионы Н+ и Сl–, концентрация ионов Н+ в растворе увеличится, но ионное произведение воды от концентрации не зависит – в таком случае уменьшается концентрация [ОН–]. Напротив, если к воде добавить щелочь, то концентрация [ОН–] увеличится, а [Н+] уменьшится. Концентрации [Н+] и [ОН–] взаимосвязаны: чем больше одна величина,тем меньше другая, и наоборот. Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10–7 моль/л, в нейтральных [Н+] = 10–7моль/л, в щелочных [Н+] < 10–7 моль/л.
Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода,называя эту величину водородным показателем и обозначаяее рН: рH =–lg[H+].
В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7.ИНДИКАТОРЫ-хим. в-ва, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации к.-л. компонента в р-ре. Указывают на определенное состояние системы или на момент достижения этого состояния. Различают индикаторы обратимые и необратимые. Изменение окраски первых при изменении состояния системы (напр., фенолфталеина при изменении рН среды) м. б. повторено многократно. Необратимые индикаторы подвергаются необратимым хим. превращениям, напр., азосоединения при окислении ионами BrO3- разрушаются. Индикаторы применяют чаще всего для установления конца к.-л. хим. р-ции, гл. обр. конечной точки титрования (к. т. т.). В соответствии с титриметрич. методами различают кислотно-основные, адсорбц., окислит.-восстановит. и комплексонометрич. индикаторы. Кислотно-основные индикаторы представляют собой р-римыеоргсоед., к-рые меняют свой цвет или люминесценцию в зависимости от концентрации ионов Н+ (рН среды). Примен. для установления конца р-ции между к-тами и основаниями (в т. ч. при кислотно-основном титровании) или др. р-ций, если в них участвуют ионы Н+, а также для колориметрич. определения рН водных р-ров. Наиб.важные кислотно-основные индикаторы приведены в табл. 1. Причина изменения цвета индикаторов в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных групп. Если индикатор слабая к-та HIn, то в водном р-ре имеет место равновесие: HIn + Н2О D In- + Н3О+. Если индикатор - слабое основание In, то: In + H2O D HIn+ + ОН-. В общем виде можно записать: Ina + Н2О D Inb + Н3О+, где Ina и Inb - соотв. кислая и основная формы индикатора, к-рые окрашены различно. Константа равновесия этого процесса Кln = [Inb][H3O+]/[Ina] наз. константой индикатора. Цвет р-ра зависит от соотношения [Ina]/[Inb], к-рое определяется рН р-ра. Буферные растворы — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли(напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор,фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).Значение pH буферного раствора можно рассчитать по формуле: 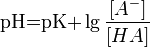 , где
, где 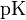 это отрицательный десятичный логарифм от константы диссоциации кислоты
это отрицательный десятичный логарифм от константы диссоциации кислоты 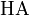 .
.
25. Гидролиз. Различные случаи гидролиза солей. Степень гидролиза. Константа гидролиза. Влияние t и C на степень гидролиза. Необратимый гидролиз. Гидро́лиз (разложение) - один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия. Гидролиз солей —это реакция взаимодействия ионов соли с водой,в результате которой образуется слабый электролит. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов »).Различают обратимый и необратимый гидролиз солей[1]:
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):


Kp=
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
ZnCl2,FeSO4,Al(NO3)3


(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)3. Гидролиз соли слабой кислоты и слабого основания:

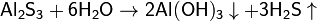
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр); α = (c гидр/ c общ)·100 %
где c гидр — число молей гидролизованной соли, c общ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза. Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:


Уравнение константы равновесия для данной реакции имеет вид:
 или
или 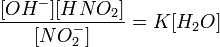 Разбавим в 10 раз раствор. Концентрации
Разбавим в 10 раз раствор. Концентрации  уменьшатся в 10 раз. Числитель уменьшится в 100 раз, а знаменатель в 10 раз. Но константа не зависит от концентрации веществ, поэтому равновесие в растворе нарушится. Чтобы равновесие установилось, числитель должен возрасти, а знаменатель уменьшится, т.е. количество соли должно гидролизоваться, концентрации
уменьшатся в 10 раз. Числитель уменьшится в 100 раз, а знаменатель в 10 раз. Но константа не зависит от концентрации веществ, поэтому равновесие в растворе нарушится. Чтобы равновесие установилось, числитель должен возрасти, а знаменатель уменьшится, т.е. количество соли должно гидролизоваться, концентрации  и
и  возрастут, а концентрация
возрастут, а концентрация  уменьшится. Таким образом, степень гидролиза соли увеличиться.Влияние t˚ на степень гидролиза вытекает из принципа Ле – Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением. Выход эндотермических реакций с ростом t˚ растёт, поэтому с повышением t˚ степень гидролиз увеличивается.
уменьшится. Таким образом, степень гидролиза соли увеличиться.Влияние t˚ на степень гидролиза вытекает из принципа Ле – Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением. Выход эндотермических реакций с ростом t˚ растёт, поэтому с повышением t˚ степень гидролиз увеличивается.
По мере уменьшения концентрации соли ее гидролиз усиливается, так как гидролиз соли лимитирован ничтожным количеством H+ и OH–-ионов, образующихся при диссоциации воды. Чем больше ионов воды приходится на долю ионов соли, тем полнее идет гидролиз.
С увеличением температуры диссоциация воды несколько возрастает, что благоприятствует протеканию гидролиза.
Влияние добавления в раствор соли кислоты, основания или другой соли можно определить исходя из принципа Ле-Шателье. В том случае, когда добавляемые электролиты связывают продукты гидролиза соли, гидролиз соли усиливается. Если же добавляемый электролит увеличивает концентрацию продуктов гидролиза или связывает исходные вещества, то гидролиз соли уменьшается.
Необратимый гидролиз (соли образованы слабым основанием и слабой кислотой). Al2S3 + 6H2O = 2Al(OH)3 + 3H2S NH4(CH3COO) + H2O NH3? H2O + CH3COOH Выводы: Если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; Реакция среды при этом нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты; Гидролиз необратим, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
Al2S3+6H2O=2Al(OH)3+3H2S
26.Комплексообразование в растворах. Структура комплексного соединения. Классификация комплексных соединений.
Комплексообразователь-определяет многие св-ва комплекса(свет,устойчивость)
27. Диссоциация комплексных соединений в растворе. Константа нестойкости. Устойчивость комплексных соединений и их разрушение. В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.Первичная диссоциация комплексного соединения - это его распад на комплексный ион, образованный внутренней сферой и ионы внешней сферы. В водных растворах первичная диссоциация комплексных соединений обусловлена разрывом ионной связи между внутренней и внешней сферами, она практически необратима:[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42+,K3[Fe(CN)6] ® 3K+ + [Fe(CN)6]3–,
Na[Al(OH)4] ® Na+ + [Al(OH)4], [Pt(NH3)4Cl2]Cl2 ® [Pt(NH3)4Cl2]2+ + 2Cl–Образующийся комплексный ион ведет себя как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. В растворе красной кровяной соли нельзя обнаружить присутствие ионов Fe3+ и CN–, а в 1М растворе хлорида дихлоротетраамминплатины(IV) [Pt(NH3)4Cl2]Cl2 обнаруживается только присутствие 2 моль хлорид-ионов, а не 4 мольНо насколько устойчива внутренняя сфера комплекса? Может ли происходить отщепление лигандов от комплексообразователя? Действительно, это возможный процесс, он называется вторичной диссоциацией комплексного соединения.Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.Так как при этом разрушаются не ионные, а ковалентные связи комплексообразователя с лигандами, этот процесс затруднен и обратим. Он происходит ступенчато:
[Ag(NH3)2]+? [Ag(NH3)]+ + NH3 1-ая ступень
[Ag(NH3)]+?Ag+ + NH3 2-ая ступень
Вторичная диссоциация характеризуется константой равновесия, причем для каждой из стадий можно вычислить свою константу. Для количественной оценки устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию. Эту константу называют константой нестойкости комплекса Кнест. В соответствии с законом действующих масс для приведенного нами выше примера диссоциации иона диамминсеребра выражение для константы нестойкости принимает вид:Чем ниже Kнест, тем прочнее и стабильнее внутренняя сфера комплексного соединения, тем в меньшей мере происходит вторичная диссоциация комплексного соединения в растворе.Концентрация ионов Cu2+, образующихся при диссоциации комплекса – иона тетраамминмеди(II), является достаточной для достижения произведения растворимости сульфида меди(II). Сульфид-ионы связывают ионы меди в осадок, практически нерастворимый в воде, концентрация Cu2+ понижается, и равновесие диссоциации [Cu(NH3)4]2+ смещается вправо, что приводит в конечном счете к разрушению комплекса.Образование одного более прочного комплексного соединения может привести в полной диссоциации и разрушению другого, менее прочного комплекса. Например, реакция:[Ag(NH3)2]Cl + 2 KCN + 2 H2O = K[Ag(CN)2] + KCl + 2 NH3 . H2Oявляется практически необратимой из-за большого значения константы образования дицианоаргентат(I)-иона. Полные константы образования катиона диамминсеребра(I) и дицианоаргентат(I)-иона равны соответственно 1,6 . 107 и 7,1 . 1019. Это значит, что комплексный ион [Ag(CN)2]- прочнее, чем [Ag(NH3)2]+. Устойчивость комплексных соединений зависит от прочности химической связи между комплексообразователем и лигандами, поэтому в зависимости от природы последних значение константы образования меняется в широких пределах. Результаты многочисленных исследований показали, что устойчивость комплексных соединений в ряду комплексообразователей марганец(II) – железо(II) – кобальт(II) – никель(II) – медь(II) увеличивается, независимо от природы лиганда и координационного числа. Это так называемый “ естественный порядок устойчивости ”.
28. Св-ва элементов 8В подгруппы.Степеньокисления.Общая характеристика элементов.Соли простые и комплексные.
9 элементов.В каждом большом периоде по 3 элемента- триада, 2 семейства
Fe,Co,Ni-семейство железа
Ru,Rh,Pd,Os,Ir,Pt-cемейство платиновых металлов
Химические свойства Fe, Co, Ni
1. Пассивируютсяконцентрированными H2SO4, HNO3 и царской водкой
2. Растворяются в кислотах
Co + 2HCl = CoCl2+ H2
10Fe + 36HNO3(разб) = 10Fe(NO3)3+ 3N2+ 18H2O
5Ni + 12HNO3(разб) = 5Ni(NO3)2+ N2+ 6H2O
3. Не растворяются в щелочах
4. Реагируют с кислородом при нагревании(мелкодисперсное чистое железо пирофорно!)
4Fe + 3O2 = 2Fe2O3 Fe3+
3Co + O2= Co3O4 Co3+, Co2+
2Ni + O2= 2NiO Ni2+
5. Железоржавеет
4Fe + 3O2+ 2H2O = 4FeO(OH)
6. Реагируютсгалогенами
FeX3(ноFeI2), CoX2(ноCoF3), NiX2
7. Реагируют с неметаллами при нагревании
Fe + S2= FeS2 3Ni + 2S = Ni3S2
Fe + P = FeP4 Co + P = CoP3
Fe + C = Fe3C (цементит)
Все платиновые металлы светло-серые и тугоплавкие, платина и палладий пластичны, осмий и рутений хрупкие. Красивый внешний вид благородных металлов обусловлен их инертностью.
Платиновые металлы обладают высокой каталитической активностью в реакциях гидрирования, что обусловлено высокой растворимостью в них водорода. Палладий способен растворить до 800—900[2] объёмов водорода, платина — до 100
Все платиновые металлы химически довольно инертны, особенно платина. Они растворяются лишь в «царской водке» с образованием хлоридных комплексов:

При окислении металлов кислородомвоздуха образуются оксиды различного состава:




При нагревании все платиновые металлы реагируют с хлором и фтором:


В растворах платиновые металлы существуют только в виде комплексных соединений. Соединения платины используют в медицине в качестве препаратов, обладающих противоопухолевой активностью
Комплексные соединения:
1.КарбонилыFe(CO)5,Co2(CO)3,Ni(CO)4
2.Катионные комплексы:
а) Аквокомплексы[Э(Н2О)6]Cl3
б) Аммиакаты [Fe(NH3)6Cl2]-неустойчив
[Fe(NH3)6Cl2]+6Н2О=Fe(OH)2+2NH4Cl+4NH3*H2O
CoCl2+6NH3*H2O=[Co+8(NH3)6]Cl2+6H2O
Ni(OH)2+6NH3*H2O=[Ni(NH3)6](OH)4+6H2O
3.Анионные комплексы:
FeCl2+6KCN=K4[Fe(CN)6]+2KCl
(желтая кровяная соль)жкс
реактив на Fe3+
4Fe3++3[Fe(CN)6]4-=Fe4([Fe(CN)6]3↓ берлинская лазурь
K3[Fe(SN)6]-красная кровяная соль
реактив на Fe2+
3Fe2++2([Fe(CN)6])2↓турмбулева смесь
K2[Ni(CN)4]
K4[Co(CN)6]
K2[Co(SCN)4]-тетрароданокобальтат(2) калия
Общая х-ка:
1.все элементы типичные Ме,2.Ярко выражены тенденции к образованию комплексных соединений,3.Каталитическая активность,4.Переменная валентность.
Степениокисления:
26Fe…3d64s2 0,+2, +3,+6
27Co…3d74s2 0,+2,+3
28Ni…3d84s2 0 ,+2,+3
44Ru…4d75s1 0,+3,+4,+6
45Rh…4d85s1 0,+3
46Pd…4d105s0 0, +2,+4
76Os…5d66s2 0,+4,+8
77Ir…5d76s2 0,+3,+4
78Pt…5d96s1 0,+2, +4,+6
29.Элементы 7 А подгруппы.Галогены. Сопоставление физических св-в и химической активности свободных галогенов.Водородные соединения галогенов.Кислородосодержащие кислоты хлора,брома,йода и их солей.
ns2np5
9F… 2s22p5c.o.-1,0 ↓радиус увеличивается,эоуменьшается,неМесв-ваослабевают,Ме усиливают,
17Cl…3s23p5c.o.-1,0,+1,+3,+5,+7(+4,+6)-исключение окислительная активность уменьшается
35Br…4s24p5c.o.-1,0,+1,+3,+5,+7(+4,+6)
53J…5s25p5c.o.-1,0,+3,+5,+7
85At…6s26p5c.o.-1,0,+1,+3
Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами, окисляют ряд сложных веществ.
Физические св-ва:
Сl2-газ,F2-газ,Br2-жидкость,J2-кристаллы(тв)
Cl2,Br2,J2-гидролиз(образуется хлорная,бромная и йодная вода)
Хим.св-ва:
F2 не реагирует с С,N2,O2
Cl2 не реагирует с O2,N2
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) Молекулы галогенов состоят из двух атомов.
4) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
5) Сила галогеноводородных кислот возрастает с увеличением атомной массы.
6) Галогены могут образовывать соединения друг с другом (например, BrCl)
Галогены - очень активные элементы. Они могут отнимать электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например фтор вытесняет хлор из хлоридов, бром из бромидов, а иод из иодидов.
Из всех галогенов только фтор, находящийся во II периоде, не имеет незаполненного d-уровня. По этой причине он не может иметь больше 1-го неспаренного электрона и проявляет валентность только -1. В атомах других галогенов d-уровень не заполнен, что дает им возможность иметь различное количество неспаренных электронов и проявлять валентность -1, +1, +3, +5 и +7, наблюдающуюся в кислородных соединениях хлора, брома и иода.
Все галогены токсичны,ков.неполярная связь-плохо растворимы в воде.
Водородные соединения галогенов:
H2+Г2=2НГ
HF-взрыв(темнота)
HCl-на свету
HJ-при нагревании
HBr
Кислородосодержащие кислоты хлора,брома,йода и их солей:
+1 HClO(хлорноватистая)HBrOHJO-соли гипохлориты
+3 HClO2(хлористая) соль-хлориты
+5 HClO3(хлорноватая)HBrO3 HJO3-соли хлораты
+7 HClO4(хлорная)HBrO4 H6JO6(HJO4*2H2O) соли перехлораты
→
силы кислот увеличиваются,окислительныесв-ва уменьшаются
30.Элементы 6А подгруппы.Общаяхарактеристика.Водородныесоединения.Оксидыигидроксидысеры,селена,теллура.Сравнениесв-в кислот селена и теллура со свойствами серы.
ns2np4
8O…2s22p4c.o.-2,0(-1,+2)
16S…3s23p4c.o.-2,0,+4,+6(+2)
34Se…4s24p4c.o.-2,0,+4,+6(+2)
52Te…5s25p4c.o.-2,0,+4,+6(+2)
84Po…6s26p4c.o.-2,0,+4,+6(+2)
| 1s22s22p4 | 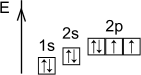
|
→
неМесв-ваослабевают,Меусилив,окислительныесв-ваослабевают,рад.атомувеличивается,эо уменьшает.
Водородные соединения:
H2O,H2S,H2Se,H2Te
→
устойчивость понижается,восстановительная активность повышается
+4 SO2 SeO2 TeO2
H2SО3 H2SeO3 H2TeO3
→
сила кислот уменьшается,восстановительныесв-ва уменьшаются
+6SO3 SeO3 TeO3
H2SO4 H2SeO4 H2TeO4
→
растворимость в воде уменьшается
в отличии от диоксида серы,SeO2,TeO2 проявляют приимущественно окислительные св-ва,легковосстанавливаясь до свободных селена и теллура,
SeO2+2SO2+2H2O=2H2SO4+Se↓
Действием сильных окислителей диоксиды селена и теллура могут быть переведены соответственно в селеновуюH2SeO4 и теллуровую H2TeO4 кислоты.Селеновая кислота H2SeO4 принадлежит к сильным кислотам.Подобно серной кислоте,онамалолетуча,энергичносоедияется с водой, обугливает органические в-ва и обладает сильными окислительными свойствами.Соли ее селинаты очень похожи на сульфаты.Бариевая и свинцовая соли этой кислоты,как и соответствующие соли серной кислоты,нерастворимы.
теллуровая кислота.H2TeO4,в отличии от селеновой и серной кислоты,очень слабая кислота.Из раствора она выделяется в виде кристаллов ортотеллуровой кислоты состава Н2ТеО6.Это шестиосновная кислота; она образует ряд солей например ортотеллурат серебра Ag6TeO6.При нагревании ортотеллуровая кислота отщепляет две молекулы воды и переходит в двухосновную кислоту H2TeO4.все соединения теллура и селена ядовиты.
Селен — аналог серы. Так же, как и серу, его можно сжечь на воздухе. Горит синим пламенем, превращаясь в двуокись SeO2. Только SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получитьселенистую кислоту (SeO2 + H2O → H2SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту H2SeO4, почти такую же сильную, как серная.
31.Элементы 4А подгруппы.Общая характеристика элементов.Отношение к кислотам и щелочам.Оксиды и гидроксиды.Соли.Сопостовление устойчивости кислотно-основных и окислительно-восстановительных свойств соединений элементов этой группы.
6С…2s22p2c.o.-4,0,+2, +4
14Si…3s23p2c.o.-4,0 ,+4
32Ge…4s24p2c.o. -4,0,+2, +4
50Sn…5s25p2 c.o.0,+2,+4
82Pb…6s26p2 c.o.0, +2,+4
→
Месв-ва возрастают,C,Si-типичные неМе,Sn,Pb-типичные Ме
+2 CО-несолеобр.GeO,SnO,PbO-амфотерные
Ge(OH)2 Sn(OH)2 Pb(OH)2
→
усиливаются основные св-ва,ослабевают восстановительные св-ва
+4 СO4-газ GeO2,SnO2,PbO2-тв. Нерастворим в воде
→
понижается кислотный характер,усиливаются окислительные св-ва
H2CO3 H2SiO3 Ge(OH)4 Sn(OH)4 Pb(OH)4
В ряду элементов VI группы главной подгруппы O – S – Se – Te – Po радиус атомов увеличивается. В связи с этим энергия ионизации уменьшается, поэтому неметаллические свойства элементов убывают, а металлические свойства элементов – растут. В реакциях с азотной кислотой сера и селен ведут себя как неметаллы, а полоний – как металл.
S + 2 HNO3 = H2SO4 + 2 NO
Se + 2 HNO3 = H2SeO4 + 2 NO
Po + 8 HNO3 = Po(NO3)4 + 4 NO2 + 4 Н2О
По химическим свойствам Se и Te очень сходны с серой. Горят на воздухе с образованием диоксидов:
Se + О2 = SeО2; Тe + О2 = ТeО2;
SeО2 и ТeО2 твердые вещества. С водородом при повышенных температурах частично взаимодействует лишь селен, теллур непосредственно с водородом не соединяется:
Н2 + Se = Н2Se
В кипящих водных растворах щелочей селен и теллур, подобно сере, медленно растворяются (диспропорционируют):
3 Se + 6 КОН = 2 К2Se + К2SeО3 + 3 Н2О
В ряду SО2 – SeО2 – ТeО2 – РоО2происходит ослабление кислотных свойств и нарастание основных свойств. Так ТeО2 можно растворить в растворе щелочи, как и предыдущие оксиды:
ТeО2 + 2 КОН = К2ТеО3 + Н2О
РоО2 со щелочами взаимодействует только при сплавлении, но взаимодействует с кислотами, проявляя основные свойства:
РоО2 + 2 КОН = К2РоО3 + Н2О
РоО2 + 2 H2SО4 = Ро(SО4)2 + 2 Н2О
| соль | кислота | название |
| 1. K2SO4 | H2SO4 – серная | Сульфат |
| 2. K2SO3 | H2SO3 – сернистая | Сульфит |
| 5. K2SeO4 | H2SeO4 – селеновая | Селенат |
| 6. K2SeO3 | H2SeO3 – селенистая | Селенит |
| 7. K2TeO4 | H2TeO4 – теллуровая | Теллурат |
| 8. K2TeO3 | H2TeO3 – теллуристая | Теллурит |
| 20. K2S | H2S – сероводородная | Сульфид |
| 21. K2Se | H2Se – селеноводородная | Селенид |
| 22. K2Te | H2Te – теллуроводородная | Теллурид |
Окислительно-восстановительные св-ва
окислительные:
H2O2+2H++2e=2H2O
H2O2+2KJ+H2SO4=K2SO4+J2+2H2O
ок-ль в-ль
2KCrO2+3H2O2+2KOH=2KCrO4+4H2O
в-ль о-ль
восстановительные:
H2O2-2e=O2+2H+
2KMnO4+5H2O2+3H2SO4=5O2↑+2MnSO4+K2SO4+8H2O
ок-ль в-ль
Кислотно-основные св-ва
32.Элементы 3А группы.Общаяхарактеристика.Степениокисления.Оксиды и гидроксиды.Солипростые,комплексные.
ns2np1
5В…2s22p1c.o.-3,0,+3
13Al…3s23p1c.o.0,+3
31Ga…4s24p1c.o.0,+1,+2, +3
49In…5s25p1c.o. 0,+1,+2, +3
81Te…6s26p1c.o.0, +1,+3
→
Месв-ва возрастают
В-неМе
Аl-амфотерный
Ga,In,Te-амфотерный
+3 B2O3
B2O3+3H2O=2H3BO3-слабая одноосновная кислота
Al2O3 Al(OH)3-нерастворим в воде,амфотерныесв-ва
Ga2O3 In2O3 Tl2O3-нерастворимы в воде
→
усиливаются основные св-ва,возрастает растворимость в кислотах
Ga(OH)3 In(OH)3 Tl(OH)3
амф. Амф. Осн.
+1 Tl2O-основный оксид Tl(OH)-щелочь
33.Элементы 2 А подгруппы.Общая характеристика элементов.Степениокисления.Гидриды,оксиды.
ns2
4Be…2s2c.o.0,+2
12Mg…3s2 c.o.0,+2
20Ca…4s2 c.o.0,+2
28Sr…5s2c.o.0,+2
56Ba…6s2c.o.0,+2
88Ra…7s2c.o.0,+2
→
Месв-ваусиливаются,восстановительныесв-ваусиливаются,активность увеличивается
Ве-соединения,ковалентнаясвязь,остальные ионные
Ca,Sr,Ba-щелочно-земельные Ме
BeOMgOCaOSrOBaO
Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2
амф. Осн. Сильно основные раствор. В воде (щелочн.)
→
основные св-ваусиливаются,растворимость в воде растет
Be(OH)2+2HCl=BeCl2+2H2O
Ca,Sr,BacH2O-образуют щелочи
Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом
Гидрид бериллия — химическое вещество с формулой BeH2. Представляет собой твердое аморфное вещество белого цвета. В сухом воздухе достаточно стабильно, во влажном — быстро разлагается
BeH2,MgH2,CaH2,SrH2,BaH2,RaH2.
Соли:
34.Элементы 1А подгруппы.Щелочныеметаллы.Общая характеристика.Гидроксиды,пероксиды,супероксиды,гидроксиды(щелочи)
ns2
3Li…2s1c.o.0,+1
11Na…3s1 c.o.0,+1
19K…4s1c.o.0,+1
37Rb…5s1 c.o.0,+1
55Cs…6s1 c.o.0,+1
87Fr…7s1c.o.0,+1
щелочные Ме,
гидроксиды растворимы в воде
-щелочи
наибольшие Rат.,наиболее сильно выражены металлические св-ва
Е<0-самые отрицательные
-активные Ме,сильные восстановители
-восстановить сам Ме можно только электрическим током
Все щелочные Ме энергично взаимодействуют с водой
2Ме+2Н2О=2МеОН+Н2
К- воспламеняется
Rb,Cs-реагируют со взрывом
соли растворимы вbоде
м/р в воде:LiF,Li2CO3,Li3PO4,NaHCO3-питьевая сода
KNO3,KCl-удобрение, в производстве стекла
Na2CO3-кальценированная сода
LiOHNaOHKOHRbOHCsOH
→
основные св-ваусиливаются,хим. Активность увеличивается,хорошо растворимы в воде(с выделением тепла)
Пероксиды
Na2O2+2H2O=2NaOH+H2O-отбеливание
Na2O2+CO=Na2CO3-противогаз
2Na2O2+2CO2=2Na2CO3+O2-для жизнеобеспечения подводных лодок
супероксиды:
4КОН+2Н2О=4КОН+3О2
4КО2+2СО2=2К2СО3+3О2
2КО2+СО=К2СО3+О2
35. Кислород. Общая хар-ка. Озон, свойства и применение. Вода. Пероксид водорода и его свойства.
| Кислород | |
| O 15,999 | |
| 2s22p4 |
Кислоро́д — элемент 16-й группы второго периода периодической системы с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).Степени окисления -2, −1, -½, -⅓, 0, ½, +1, +2.Кислород имеет три устойчивых изотопа: 16О, 17О и 18ОВ настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация.Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
 Используют также реакцию каталитического разложения перо
Используют также реакцию каталитического разложения перо