Контрольная работа
По дисциплине «Физиология растений»
Студентки 4 курса,
Заочной формы обучения
Афауновой З.Х.
Научный руоводитель:
Кандидат сельскохозяйственных наук,
Доцент кафедры Биологии и
методики ее преподавания
Виктор Юрьевич Асеев
Рязань 2019
Содержание
1. Пероксиомы, глиоксиомы, липосомы…………………………………………….3-6
2. Осмотическое поглощение воды растительной клеткой………………………..7-10
3. Энергетика цикла Кребса………………………………………………………….11-13
4. Список использованной литературы……………………………………………...14
Пероксиомы, глиоксиомы, липосомы
Строение. Пероксисомы – органеллы, имеющиеся во всех эукариотических клетках, овальной формы, диаметром 0,3- 1,5 мкм, отграничены от цитозоля одной мембраной,. Содержимое – средней электронной плотности, есть плотная сердцевина, в которой просматривается кристаллическое строение, биохимические исследования показали, что она состоит из уратоксидазы. Количество, размеры, содержимое и форма пероксисом варьируют в разных клетках. Пероксисомы выглядят очень простыми, однако они обладают большим набором функций и играют важную роль в в метаболизме клеток. Впервые пероксисомы идентифицировали как самостоятельные органоиды, именно благодаря их способности к выработке перекиси водорода.Само название «пероксисомы» отражает вовлечение этих органоидов в метаболизм перекиси водорода. Помимо различных оксидаз, пероксисомы содержат ферменты, вовлеченные в b-окисление длинноцепочечных жирных кислот. Этот процесс очень важен для нормального функционирования клетки.
Размножение пероксисом прямым делением показано в ряде работ. От существующей пероксисомы отпочковывается новая, меньших размеров. Наблюдали даже формирование цепочек мелких новых пероксисом. Интересным свойством пероксисом является их способность увеличиваться в количестве при воздействии гиполипидемических препаратов и промышленных пластификаторов.
Функции пероксисом разнообразны, одна из наиболее важных – окисление длинных и очень длинных жирных кислот. Пероксисомы вовлечены также в синтез желчных кислот и холестрина, метаболизм аминокислот и пуринов. Перенос молекул в сформировавшуюся пероксисому из цитозоля осуществляется через мембрану, при этом работают специфические сигнальные последовательности. Белки пероксисом – пероксины, они ответственны за транспорт в матрикс пероксисомы. Особенностью пероксисом является ориентация С-конца трансмембранных белков в сторону плазмалеммы. В растительных клетках пероксисомы выполняют целый ряд функций, связанных с фотодыханием и метаболизмом жирных кислот. Пероксисомы имеют специфическую систему переноса электронов, не связанную с генерацией протонного потенциала и синтезом АТФ. В результате работы этой цепи формируется Н2О2, которая затем расщепляется каталазой пероксисом. Т.о., пероксисомы осуществляют биологическое окисление, но энергетически неэффективное, - нет синтеза АТФ и НАДН.

Рис.1. Строение периксиомы.
Глиоксисомы – разновидность пероксисом растений, в которых происходит окисление жирных кислот и глиоксилатный цикл. Образующаяся янтарная кислота используется для синтеза углеводов. Глиоксисомы функционируют в клетках в процессе роста, когда происходит мобилизация жиров (прорастание семядолей и др.). Долгое время считалось, что глиоксилатный цикл есть только у растений, однако затем было показано, что при голодании у млекопитающих появляются ферменты глиоксилатного цикла, позволяющие расщеплять запасные жиры. Гликосомы – разновидность пероксисом, участвующая в метаболизме гликолата, который образуется при фотодыхании – фотопероксисомы. Часто на электронограммах видны ассоциаты хлоропластов, пероксисом и митохондрий.
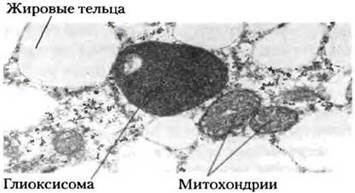
Рис.2. Расположение глиоксиомы.
Липосомы - это двуслойные или многослойные сферические образования (мицеллы) получаемые при определенных, чаще всего механических воздействиях на дисперсии фосфолипидов в воде. Двуслойные липосомы (моноламелярные липосомы) состоят из двойного слоя фосфолипидов с водной фазой внутри. Размер их порядка нескольких сотен нм - 200-300 нм. Многослойные липосомы (т.н. мультиламелярные липосо-мы) состоят из нескольких концентрических бислоев фосфолипидов с внутренней полостью, заполненной водными растворами лекарственных веществ. Размер их до многих сотен нм и даже до 1 мкм. Как правило, в технологии липосом чаще используются фосфоглицериды, в которых одна из гидроксильных групп глицерина этерифицирована насыщенной жирной кислотой, вторая - ненасыщенной, а третья - фосфатидной кислотой. Во всех фосфолипидах (фосфоглицеридах) фосфатидная кислота (остаток - фосфатидил) через группировку – ОН – соединена с каким-либо (спиртовым) остатком – этаноламином (фосфоглицерид носит тогда название фосфатидилэтаноламин), холином (фосфатидилхолин), серином (фосфатидилсерин) или даже фосфатидилглицерином (кардирлипин). Таким образом, фосфоглицериды имеют неполярную часть, т.е, остаток диацилглицерина, и полярную часть, представленную фосфатом и спиртовыми остатками.
Благодаря полярному гидрофильному концу фосфоглицериды обладают некоторой растворимостью в воде, образуя в водной среде мицеллы. В мицеллах гидрофобные радикалы жирных кислот группируются, образуя внутреннюю гидрофобную зону мицеллы. Гидрофильные участки располагаются по внешней поверхности мицеллы, обращенной в водную фазу. При механической или ультразвуковой обработке смеси, состоящей из диспергированных в воде фосфолипидов и растворенных в этой воде лекарственных веществ образуются сферические мицеллы - липосомы, оболочка которых состоит из двойного слоя молекул липида, в котором гидрофильные полярные группы обращены к водному раствору лекарственных веществ, а гидрофобные - друг к другу.

Рис.3. Многослойная мицелла фосфолипида.
Наиболее распространенная техника получения бислойных липосом заключается в приготовлении жировой эмульсии из какого-либо фосфоглицерида в воде, например, фосфатидилхолина или фосфатидной кислоты с помощью ультразвука, внесение в такую эмульсию водного раствора лекарственного вещества и последующей обработке системы ультразвуком низкой энергии. Обычно удается включить в липосомы от 1 до 15% находящегося в водном растворе вещества. После окончания формирования самих липосом производится многократная отмывка их от некапсулированного лекарственного вещества. Лекарственное вещество полностью сохраняет свою активность в форме липосом.
Многослойные липосомы можно получить методом многократного замораживания суспензии фосфолипидов с помощью жидкого азота и последующего оттаивания.

Рис.4. Липосомы. Образование и виды.
Осмотическое поглощение воды растительной клеткой
Под осмосом понимается диффузия воды через полупроницаемые мембраны. Полупроницаемость мембран - это их свойство пропускать воду и не пропускать растворенные вещества. Явление осмоса было открыто в 1828 г. французским ботаником Дютроше. Позже Пфеффером были сконструированы физические приборы - осмометры (осмотические ячейки). Живая растительная клетка обладает свойствами только что разобранной осмотической системы. Поскольку молекулы воды проходят через клеточные мембраны намного быстрее, чем растворенные вещества, можно с известной долей погрешности говорить о полупроницаемости мембран. Роль полупроницаемой мембраны (хоть и не идеальной) выполняют, прежде всего, плазмалемма и тонопласт, раствора клеточный сок вакуоли клетки.
Передвижение воды через полупроницаемые мембраны подчиняется следующим законам:
1. Осмотическое давление прямо пропорционально концентрации раствора - числу частиц в единице объема независимо от размеров и природы частиц (молекул или ионов).
2. Всякое вещество, концентрация которого равна 1 моль/л, развивает осмотическое давление, равное 22,4 атм (для неэлектролита) при 0°С.
3. Осмотическое давление пропорционально абсолютной температуре Т = 273 + t °С.
4. Осмотическое давление раствора, содержащего несколько веществ, равно сумме осмотических давлений, вызываемых каждым из них.
Осмотическое давление подчиняется в общем виде закону Вант-Гоффа и выражается уравнением Р = CRTi, где Р - осмотическое давление; С - молярная концентрация раствора; R - газовая постоянная, равная 0,0821 л · атм / град. моль; Т - абсолютная температура; i - изотонический коэффициент, показывающий отношение числа частиц (молекул и ионов) в растворе к исходному числу молекул растворенного вещества. Для растворов неэлектролитов, например для сахара, изотонический коэффициент равен 1, для электролитов - больше 1.
Если клетку поместить в воду, то она, как и осмометр, будет поглощать ее и тем сильнее, чем выше концентрация клеточного сока. Но до каких пор клетка будет поглощать воду? При всасывании клеткой воды объем клеточного сока увеличивается, и цитоплазма начинает давить на оболочку клетки, растягивая ее. Оболочка, обладая значительной прочностью и вместе с тем эластичностью, в свою очередь оказывает сопротивление всякой силе, стремящейся ее растянуть, и тем большее, чем более она растянута. После прекращения действия растягивающей силы стенка снова возвращается к своим прежним размерам. Напряженное состояние клеточной стенки, вызванное давлением клеточного содержимого, носит название тургора, а противодавление оболочки на протопласт - тургорного давления. Примером этого могут служить клетки водорослей и водных высших растений. Их клетки всегда находятся в состоянии почти полного насыщения.Клетки наземных растений, наоборот, почти никогда не бывают полностью насыщенными водой. Благодаря потере воды листьями в процессе транспирации они обычно не достигают состояния полного тургора. По отношению к концентрации клеточного сока внешние растворы могут быть: гипертоническими, осмотическое давление которых больше осмотического давления клеточного сока; изотоническими, осмотическое давление которых равно осмотическому давлению клеточного сока; гипотоническими, у которых это давление меньше, чем давление клеточного сока.
При помещении живой растительной клетки не в воду, а в гипертонический раствор тургор будет стремиться к нулю, а сосущая сила - к величине полного осмотического давления S = Р. В данном случае будут происходить следующие явления: раствор оттянет воду из клетки, клеточная стенка сократится, сократится и цитоплазма клетки, тургор исчезнет. Раствор начнет входить в пространство между стенкой и цитоплазмой, т. е. цитоплазма будет отходить от клеточной стенки. Это отставание цитоплазмы от оболочки клетки при погружении последней в гипертонический раствор называется плазмолизом. Плазмолиз свидетельствует о том, что имеются различия в проницаемости клеточной стенки и цитоплазмы, и, что самое главное, показывает, что цитоплазма жива.
Если плазмолизированную клетку снова поместить в воду, то происходит обратная картина: клетка всасывает воду, объем протопласта увеличивается; цитоплазма начинает плотно примыкать к стенке клетки. Переход плазмолизированной клетки в нормальное состояние носит название деплазмолиза.
В природной обстановке, например, при пересадке растений на засоленную почву, осмотическое давление почвенного раствора может быть выше, чем осмотическое давление клеточного сока. В этом случае не только будет поглощаться такими клетками, но, наоборот, будет выходить из клеток, вызывая обезвоживание последних, а затем и отмирание растения.
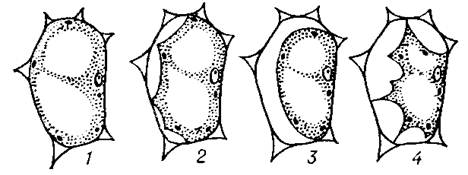
Рис.5. Основные формы плазмолиза. (1- начальная стадия; 2 - вогнутый; 3 - выпуклый (время перехода от вогнутого плазмолиза к выпуклому служит показателем вязкости цитоплазмы); 4 - судорожный (при быстром действии концентрированного плазмолитика и высокой степени вязкости цитоплазмы).
Если потеря тургора происходит не в растворе, как при плазмолизе, а от высыхания в воздухе в жаркие дни, то наблюдается явление циторриза. Цитоплазма при этом от клеточной стенки не отстает, а остается как бы припаянной к ней. Стенки клеток, выпячиваясь внутрь, деформируются, стремятся разорвать цитоплазму с определенной силой (силой циторриза).
Внешние условия существенно влияют на показатели осмотического давления и сосущей силы. Они очень низкие у водных растений (за исключением растений морей и других засоленных водоемов) и растений болот и высокие - у растений засушливых мест. У морских водорослей осмотическое давление достигает 25 - 30 атм. Клетки растений, произрастающих на засоленных почвах, развивают давление, измеряемое 100-150 атм. Растения открытых местообитаний отличаются более высокими величинами осмотического давления и сосущей силы, чем растения затененных мест. Камбиальные клеткистволов древесных растений имеют осмотическое давление 20 - 30 атм. Паренхимные клетки содержат клеточный сок в концентрациях, соответствующих осмотическому давлению 4 - 5 атм. Сосущая сила клеток хвои ели в таежной зоне достигает 15 - 35 атм, а поглощающих корней колеблется от 6 до 8 атм (у сосны - от 6 до 11 атм).
Для определения осмотического давленияиспользуют плазмолитический и криоскопический методы. Плазмолитический метод основан на том, что в растворах плазмолитиков (веществ, вызывающих плазмолиз) разной концентрации начало уголкового плазмолиза клеток будет наблюдаться в том из них, осмотическое давление которого почти соответствует осмотическому давлению клеточного сока (изотонический раствор). Криоскопический метод основан на определении температуры замерзания отжатого клеточного сока. Осмотические свойства клеток не только определяют поглощение воды растением, но и лежат в основе многих физиологических процессов, определяют различные виды движений у растений, в частности движения устьиц. От осмотических явлений в значительной мере зависит рост клеток. Упругое состояние тканей и органов растения (их тургесцентность) влияет на внешний вид и форму растения. Большая роль принадлежит осмотическим явлениям в передвижении воды и растворенных веществ, устойчивости растений к неблагоприятным внешним воздействиям, регулировании такого сложного процесса, как фотосинтез.