План:
II.2.1. Структура белковых молекул.
II.2.1.1. Первичная структура белка.
II.2.1.2. Вторичная структура белка.
II.2.1.3. Третичная структура белка.
II.2.1.4. Четвертичная структура белка.
II.2.2. Денатурация белковых молекул.
II.2.3. Гидратация белковых молекул.
II.2.4. Белковый состав и строение тканей мяса.
II.2.4.1. Строение мышечного волокна.
III.2.4.2. Состав мышечной ткани.
III.2.4.2.1. Саркоплазматические белки мышечной ткани.
III.2.4.2.2. Миофибриллярные белки мышечной ткани.
III.2.4.2.3. Экстрактивные вещества мышечной ткани.
III.2.4.3. Строение соединительной ткани.
III.2.4.4. Состав соединительной ткани.
III.2.4.4.1. Коллагеновые волокна.
IV.2.4.4.2. Эластиновые волокна.
IV.2.5. Влияние тепловой обработки на физико-химические свойства белков мяса.
IV.2.6. Белки рыбы и их изменения при кулинарной обработке.
V.2.7. Белки молока и их изменения при кулинарной обработке
V.2.8. Белки яиц и их изменения при кулинарной обработке
V.2.9. Белки овощей, фруктов и их изменения при кулинарной обработке.
V.2.10. Белки зерномучных продуктов и их изменения при кулинарной обработке.
V.2.11. Влияние кулинарной обработки на питательную ценность и перевариваемость белков.
II.2.1. Структура белковых молекул
Белок – высокомолекулярное азотсодержащее органическое соединение. Молекулы белка построены из остатков аминокислот. Обязательный компонент – a-аминокислоты – производные карбоновых кислот.
Состав белков: 51% С, 2–23% О, 15–18% N, 6,7% H, 0,3–2,5% S.
Полноценные белки – это те белки, в которых есть все незаменимые аминокислоты (белки животного происхождения).
Неполноценные белки – это те белки, в которых недостает одной и более незаменимых аминокислот (растительные белки).
Аминокислоты - это производные жирных кислот, у которых один атом водорода в альфа положении заменен на аминогруппу.

Незаменимые аминокислоты – это те аминокислоты, которые не синтезируются организмом.
Различают 4 структуры организации белков.
II.2.1.1. Первичная структура белка
Первичной структурой белка называют молекулярную полипептидную цепь, состоящую из остатков аминокислот.

Аминокислоты данной цепи объединены ковалентными пептидными связями, которые образуется путем соединения аминной и карбоновой групп двух близлежащих аминокислот.
Каждый пептид имеет свое название. Если объединены две аминокислоты, то это дипептид, если три – трипептид и т.д.
Название пептида, дипептида и т.д. складывается из перечисления аминокислот, которые входят в его состав. Перечисление аминокислот начинают с той аминокислоты, которая имеет свободную аминогруппу. Последней ставится кислота, которая имеет свободную карбоксильную группу. В названии аминокислота окончание “ин” меняет на “ил”, а последняя аминокислота название не изменяет (лейцилфенилтрионин – трипептид).
Особенность первичной структуры белка заключается в том, что прочные ковалентные связи с аминными и карбоксильными группами чередуются с подвижными участками.

II.2.1.2. Вторичная структура белка
Вторичная структура белка образуется благодаря водородной связи между пептидами. Вторичная структура представляет собой a-спираль (по часовой стрелке).
Особенности вторичной структуры белка. Конфигурация полипептидной связи образует винтовую симметрию. Образование водородной связи идет между пептидными группами каждого первого и четвертого аминокислотных остатков. Ветки в спирали регулярные. Все аминокислотные остатки a-спирали равнозначны, независимо от боковых радикалов. Боковые радикалы в образовании вторичной структуры не участвуют. Высота одного витка 0,54 нм. В эту высоту укладывается 3,6 аминокислотных остатков. Кроме a-структуры существует b-структура – это разновидность вторичной структуры. Она характеризуется тем, что на определенных участках есть a-спираль и эта спираль имеет конфигурацию со слабым изгибом. Белки на 100% не могут иметь a- или b-структуру, они соединяют в себе обе эти структуры.
II.2.1.3. Третичная структура белка
Третичная структура белка – определенный способ укладки полипептидной цепи в пространстве. В стабилизации третичной структуры играют важную роль боковые радикалы аминокислот. Молекулы белка из a-спирали переходят в глобулу (глобулярные) или в канаты одно- и многожильные (фибриллярные). Глобулярные белки имеют эллипсовидную форму. Фибриллярные белки имеют выпуклую форму в виде веретена или палочки. Для примера третичную структуру имеют: коллаген, ретикулин, эластин.
Особенности третичной структуры белка. Конформация (или расположение) белка определяется боковыми радикалами аминокислот. При укладке полипептидная цепь белка старается принять такую форму, чтобы обладать наименьшим запасом энергии. Только правильная укладка белка в пространстве делает его активным и любые изменения ведут к нарушению его биологической деятельности. Связи можно разделить на:
а) сильно ковалентные;
б) слабые.
II.2.1.4. Четвертичная структура белка
Четвертичная структура белка построена из нескольких полипептидных цепей, имеющих вторичную и третичную структуры. Белки представляют собой объединение нескольких белковых молекул в единую молекулу белка. Например, актомиозин состоит из актина и миозина – способствует сокращению мышц; гемоглобин крови состоит из 4-х полипептидных цепей, объединенных в одну глобулу.
II.2.2. Денатурация белковых молекул
Денатурация – это нарушение нативной (природной, неизменной) структуры белковых молекул. Полностью обезвоженные белки очень плохо денатурируют. Денатурация – нарушение вторичной, третичной и четвертичной структур.
Деструкция – нарушение первичной структуры.
Факторы, вызывающие денатурацию
- Нагревание (тепловая денатурация, 50 ¸ 60°С).
- Встряхивание или взбивание (механическая денатурация).
- Высокая концентрация Н+ или ОН– ионов (кислотная или щелочная денатурация).
- Дегидратация (при сушке или при замораживании).
При денатурации происходит следующее:
- Снижается или теряется биологическая активность белковых молекул.
- Снижается или теряется способность растворяться в характерных для белков растворах.
- Изменяются формы и размеры белковых молекул (об этом можно судить по коэффициентам преломления и по вязкости раствора).
- Изменяется положение химически активных групп (денатурированные белки дают более интенсивные цветные реакции, чем нативные).
- Сдвигается изоэлектрическая точка и для большинства белков сдвиг идет в сторону повышения рН среды. Это обусловлено тем, что изменяется соотношение кислых и основных групп на поверхности белковых молекул.

- Денатурированные белки легче подвергаются воздействию протеолитических ферментов (пепсина, трипсина, химотрипсина), что улучшает переваривание пищи, если денатурация не находится в стадии глубокой денатурации.
Полностью обезвоженные белки очень плохо денатурируют.
Постденатурационные изменения – это изменения, наступающие после денатурации.
В результате денатурации белки теряют свою гидратную оболочку, кроме этого на поверхности белковой молекулы после денатурации увеличивается количество химически активных групп.
При дальнейшем нагревании денатурированных белковых молекул, если речь идет о тепловой денатурации, они начинают взаимодействовать друг с другом, при этом образуются макромолекулы, которые выпадают в осадок, т.е. происходит коагуляция белковых молекул.
При коагуляции белки с определенной концентрацией в растворе ведут себя по-разному.
1. Если имеются разбавленные растворы белков (разбавленные золи) с концентрацией 1 – 1,5%, то при нагревании таких растворов белков наступают сначала денатурационные изменения, а в результате постденатурационных изменений образуются пены (бульоны).
2. Если имеются более концентрированные золи с концентрацией 1,5 – 2%, то в результате постденатурации образуются гели (варка яйца).
3. Если имеется белок в состоянии геля, то в результате постденатурации образуется коагель (плотный гель) и выделяется вода (белки мышечной ткани).
Коагулированный белок теряет способность к набуханию. Глобулярные белки прошедшие постденатурационные изменения (коагуляцию), перевариваются хуже, чем денатурированные.
II.2.3. Гидратация белковых молекул
На поверхности белковых молекул имеются активные группы:
а) свободные полярные группы;
б) связанные полярные группы.
Свободными полярными группами называются аминогруппы и карбоксильные группы.
Свободные полярные аминогруппы есть у таких аминокислот как лизин. Свободные полярные карбоксильные группы имеются у аспарагиновой и глютаминовой аминокислот.
Белковая молекула, в состав которой входят в основном аспарагиновая и глютаминовая аминокислоты, при диссоциации имеет отрицательный заряд за счет превалирования карбоксильных групп.

Если в белковой молекуле преобладает лизин, то при диссоциации белковая молекула имеет положительный заряд.

Связанные полярные группы – это сульфгидрильная (SH–) и пептидная группы.
Молекулы воды обладают полярностью. При контакте с белковой молекулой диполи воды адсорбируются на поверхности белка вокруг полярных групп, образуя гидратную оболочку белка.

Основная часть воды более или менее связанная с белками называется адсорбционной. Различают два вида адсорбционной воды:
1. Ионная адсорбционная вода – это вода, которая связана свободными полярными группами.
2. Молекулярная адсорбционная вода – это вода, адсорбированная за счет связанных полярных групп.
Количество молекулярной адсорбционной воды для белковой молекулы постоянно.
Количество ионной адсорбционной воды для белковой молекулы непостоянно, и зависит от рН среды.
Если белок находится в изоэлектрическом состоянии, то ионная адсорбция минимальна.
Изоэлектрическая точка – значение рН среды, при котором заряд белковой молекулы равен нулю.

Когда белковая оболочка теряет заряд и теряет гидратную оболочку обводненность молекулы белка наименьшая. Каждая молекула воды способна образовывать 4 водородных связи, которые распределяются между полярными группами белка и соседними молекулами воды. В результате адсорбционная вода в белке прочно связана, она не отделяется самопроизвольно и не служит растворителем для других веществ.
Если растворы белка небольшой концентрации, то молекулы белка обводнены полностью (молоко, жидкое тесто).
В концентрированных белковых растворах и обводненных белковых студнях при обводнении водой происходит дополнительная гидратация (фарш, омлет).
При гидратации белковых молекул повышается липкость массы а, следовательно, хорошо формуются изделия и готовые изделия имеют большую сочность.
Если белки сухие (белки муки), то при добавлении воды белки набухают, и получается обводненный гель – студень (клейковина).
В пищевых продуктах кроме адсорбционной воды существует свободная вода, она не связана с белками и может свободно выпрессовываться. Она содержит витамины, минеральные вещества. Свободная вода связана в пищевых продуктах осмотически и капиллярно.
II.2.4. Белковый состав и строение тканей мяса
В живом организме различают:
а) мышечную ткань;
б) соединительную ткань.
II.2.4.1. Строение мышечного волокна
Основной тканью организма является мышечная ткань, она состоит из мышечных волокон.
Мышечное волокно – субъединица сложного строения, своеобразная многоядерная клетка.
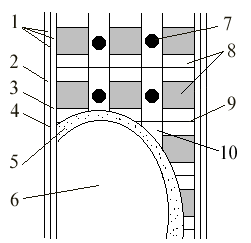
Рис.1. Строение мышечного волокна
В состав мышечного волокна (см. рис.1) входит сарколемма 1, которая покрывает мышечное волокно, она неоднородна, состоит из наружного (гомогенного) 2 и внутреннего (плазмолеммы) 3 слоев, между ними находится липидный слой 4. В состав мышечного волокна входят миофибриллы 8, они неоднородны и могут расщепляться на протофибриллы или на миофиламенты. Миофибриллы имеют темные и светлые диски. Посередине светлого диска идет темная полоса 9, называемая z-полосой. Расстояние между двумя z-полосами называется саркомером. Миофибриллы погружены в жидкий золь, который называется саркоплазма 10. В саркоплазму также помещены митохондрии 7. Прилегающая к ядру 6 саркоплазма имеет зернистое строение и называется цитоплазма 5. Внешний слой сарколеммы состоит из эластиновых и ретикулиновых волокон, они не растворяются в кислотах и щелочах, очень прочны, пропускают сахара, жирные кислоты, аминокислоты. Внутренний слой сарколеммы – мембрана.
Длина мышечного волокна может достигать 12 см, а диаметр 10–150 мкм.
ЛЕКЦИЯ № III
III.2.4.2. Состав мышечной ткани
Белки 16,5–20,9%, вода 72–80%, азотистые экстрактивные вещества 1–1,72%, безазотистые экстрактивные вещества 0,7–1,5%, липиды 2–3%, минеральные вещества 1–1,5%.
Если высушить мышечную ткань, то белки будут составлять 80% сухой массы.
Белки определяют пищевую ценность мяса, физико-химические показатели мяса и являются определяющими соединениями при тепловой обработке.
Все белки мышечной ткани делятся на три группы:
1. Саркоплазматические белки составляют 35% от всех белков мышечной ткани.
2. Миофибриллярные белки составляют 45% от всех белков мышечной ткани.
3. Белки-стромы (соединительно-тканные белки).
По состоянию мышечных белков определяют консистенцию, влагоудерживающую способность, эмульгирующую способность мышечной ткани и цвет мяса.
III.2.4.2.1. Саркоплазматические белки мышечной ткани
Саркоплазма – цитоплазма мышечных волокон и клеток; заполняет пространства между миофибриллами. Содержит структуры, обеспечивающие проведение возбуждающих импульсов внутри волокна.
Характерной особенностью белков саркоплазмы является то, что они растворяются в воде и слабых солевых растворах. К этой группе относятся следующие белки: миоген, глобулин х, миоальбумин, миоглобин, липопротеиды.
Фракция миогена состоит из подфракций А, В, С. Молекулярная масса миогена 81–150 углеродных единиц. Миоген составляет 20% от белков саркоплазмы. Температура коагуляции 55–66°С. Аминокислотный состав хорошо сбалансирован по незаменимым аминокислотам, миоген относится к полноценным белкам. Изоэлектрическая точка рН= 6–6,5. Биологическое значение: регулирует углеводный обмен в организме.
Глобулин х составляет 20% от белков саркоплазмы, относится к солерастворимым белкам. Изоэлектрическая точка рН = 5,2, температура коагуляции 50°С. Биологическая роль многофункциональна.
Миоальбумин составляет 1–2% от всех белков мышечной ткани, относится к типичным альбуминам, водорастворим. Изоэлектрическая точка рН = 3–3,5, температура коагуляции 45–47°С. Выполняет в организме роль ферментов.
Миоглобин относится к классу хромопротеидов, обусловливает красную окраску мышечной ткани. Содержание в мышцах 1%. Его количество в мышечной ткани зависит от возраста животного. Наиболее нагруженные мышцы животного имеют больше миоглобина. Функция в организме: транспортирует кислород от гемоглобина крови к ферментной системе каждой клетки организма. Молекулярная масса 17×103 углеродных единиц, денатурирует при 60°С. Миоглобин состоит из белковой части (глобин) и простетической (гем). Гем представлен атомом железа, связанным с азотом четырех пиррольных колец, а также с глобином и другими соединениями.

Если (6) пиррольная связь занята водой, то соединение называется миоглобин.
Если (6) связь занята кислородом, то соединение называется оксимиоглобин.
Если (6) связь занята ОН, то соединение называется метмиоглобин и железо имеет валентность +3.
Миоглобин имеет пурпурно-красный цвет, оксимиоглобин имеет ярко-красный цвет, метмиоглобин имеет коричневый цвет. При тепловой обработке миоглобин денатурирует. При денатурации оксимиоглобина образуются гемохромы и гемотины, которые имеют серо-коричневый цвет у готового мяса.
У гемохрома такое же строение как у миоглобина, но глобин денатурирован, а простетическая группа та же.
Гемотин и метмиоглобин имеют одинаковое строение, но у гемотина глобин денатурирован.
Для сохранения цвета мяса в колбасных изделиях применяют нитраты.
В саркоплазме есть белок, который связывает ионы кальция, кальмодулин. Он играет роль посредника во многих обменных процессах, влияет на сокращение мышечной ткани и на ее консистенцию.
III.2.4.2.2. Миофибриллярные белки мышечной ткани
В состав миофибрилл входят белки сократительной системы. К этой группе относятся: миозин, актин, актомиозин, тропомиозин, тропонин.
Миозин составляет 55% от суммы всех белков миофибрилл. Молекулярная масса 450×103 углеродных единиц. Имеет четвертичную структуру, его молекула вытянутой формы и состоит из двух полипептидных цепочек. В молекуле различают хвост и голову. В аминокислотный состав миозина входят все незаменимые аминокислоты. В молекуле 5×103 остатков аминокислот, 30% остатков аминокислот кислого характера: аспарагиновая и глютаминовая аминокислоты. Миозин имеет кислый характер и обладает большой водосвязывающей способностью, связывает ионы Ca, K, Mg.

Важным свойством миозина является способность катализировать расщепление АТФ до АДФ+Н3РО4+энергия.
Денатурирует при 40°С, изоэлектрическая точка рН = 5,1 – 5,2.
Актин составляет 25% от всех белков миофибрилл. Существует две формы актина: глобулярный (Г-актин) и фибриллярный (Ф-актин). Г-актин имеет двухцепочную спиральную структуру, каждый виток включает 13–14 молекул глобулярного актина.
Денатурирует при 45–50°С, изоэлектрическая точка рН = 4,7.
Актин и миозин способны создавать сложный белок актомиозин. Он образуется в процессе мышечного сокращения, при этом головка миозина соприкасается с глобулой актина и образуется белок, имеющий молекулярную массу 1600–3900 углеродных единиц и отвечающий за сократительную функцию организма.
Тропомиозин составляет 4–7% от всех белков миофибрилл. Молекулярная масса 70×103 углеродных единиц. Представляет собой две спирали длиной 40 нм. Белок неполноценный, не содержит триптофан. Денатурирует при 50 – 60°С, изоэлектрическая точка рН = 4,6.
Тропонин – глобулярный белок, составляет 2% от всех белков миофибрилл. Молекулярная масса 80×103 углеродных единиц. Молекулы тропонина способны связывать Ca и OH, активизировать расщепление АТФ.
В состав мышечного волокна входят липиды, их состав около 3%. Часть липидов входит в виде фосфолипидов в состав мембран, митохондрий и других структурных единиц. Запасные липиды есть в саркоплазме, межклеточной соединительной ткани и представлены триглицеридами. Состав триглицерида зависит от вида животного.
III.2.4.2.3. Экстрактивные вещества мышечной ткани
Азотистые вещества – небелковые вещества, содержащие азот (мочевина, мочевая кислота, пуриновые основания, свободные аминокислоты, глютаминовая кислота повышает секрецию желудочного сока, карнозин, ансерин, криотин, криотинфосфат, АТФ, АДФ). Криотин и криотинфосфат составляют 60% от всех азотистых экстрактивных веществ.
Безазотистые экстрактивные вещества: гликоген и продукты его превращения составляют 1%. Гликоген в процессе жизнедеятельности организма расщепляется до молочной кислоты, ПВК, глюкозы, мальтозы, которые являются безазотистыми экстрактивными веществами.
Витамины, входящие в состав мышечного волокна: витамины группы В – В1, В2, В6, В12, РР.
Витамин В1 при рН = 7 в процессе нагревания до 96°С в течение часа теряется на 80%.
Витамин В2 при рН = 7 и при температуре 120°С (автоклавирование) теряется на 50%, а при температуре 100°С сохраняется хорошо.
Витамин В6 устойчив к нагреванию, но разрушается под действием дневного света.
Витамин В12 не теряет активность при температуре 120°С в течение 15 минут.
III.2.4.3. Строение соединительной ткани
Соединительная ткань состоит из клеток (главным образом фибробластов), волокон и осн. в-ва. Выполняет опорную, трофическую (питательную) и защитную функции. Различают собственно соединительную ткань (подкожная клетчатка, сухожилия, связки), костную и хрящевую, ретикулярную, жировую. К соединительной ткани относят также кровь и лимфу.
Отдельные мышечные волокна соединяются между собой в первичные пучки при помощи соединительно-тканной прослойки, которая называется эндомизием.

Рис.2. 1 – эндомизий, 2 – перемизий
Первичные пучки соединяются во вторичные, третичные и пучки высших порядков и эти пучки высших порядков объединены более толстой соединительно-тканной прослойкой, которая называется перемизием.
Мускулы – совокупность пучков высшего порядка, покрытая эпимизием.
III.2.4.4. Состав соединительной ткани
Соединительная ткань составляет 50% массы тела животного, она входит в состав хрящей, сухожилий, костей, стенок и сосудов в качестве межклеточного вещества мышц, в состав клетчатки.
Для всех видов соединительной ткани характерно наличие внеклеточных волокнистых структур: коллагеновых и эластиновых волокон.

III.2.4.4.1. Коллагеновые волокна
Коллагеновые волокна соединительной ткани содержат белок коллаген, на его долю приходится 1/3 всех белков соединительной ткани. Коллагеновые волокна построены из фибрилл различного диаметра, которые имеют поперечную исчерченность.
ЛЕКЦИЯ № IV
26 сентября
При рассмотрении количества соединительной ткани в теле животных определено, что белки соединительной ткани составляют до 50% от всех белков животного. Это зависит от породы, пола, состояния животного.
Коллаген – основной белок соединительной ткани, составляет 1/3 всех белков. Коллаген входит в состав коллагеновых волокон, которые построены из фибрилл разного диаметра (это зависит от того, где расположены коллагеновые волокна). Фибриллы построены из макромолекул коллагена (тропоколлагена).
Тропоколлаген. Молекулярная масса 3600 углеродных единиц, состоит из трех полипептидных цепочек, которые образуют тройную спираль, диаметр 1,5 нм, длина 360 нм.
Каждая цепочка тропоколлагена состоит из 1000 остатков аминокислот и каждая имеет молекулярную массу 1200 углеродных единиц. Стабилизация происходит за счет многочисленных водородных связей.
Аминокислотный состав коллагена (основа тропоколлагена): глицин 33%, пролин, оксипролин 21%, аланин 11%. В коллагене отсутствуют: триптофан, цистин, цистеин, очень мало метионина и тирозина. Таким образом коллаген относится по своему аминокислотному составу к неполноценным белкам.
В лабораторных условиях по оксипролину (оксипролиновое число) судят о количестве коллагена в частях животных. Коллагеновые волокна имеют высокую способность к набуханию, это влияет на консистенцию мяса.
Нативный коллаген не растворяется в воде, но набухает, устойчив к действию протеолитических ферментов (пепсин, трипсин). Подвергается воздействию коллагеназы (фермент поджелудочной железы), но степень расщепления невелика.
Процесс тепловой обработки приводит к процессу дезагрегации коллагена. При умеренном тепловом воздействии нарушается связь между полипептидными цепочками (сваривание), увеличивается доступ ферментов к пептидным связям. Повышение температуры до 90°С и увеличение времени нагрева приводит к гидротермическому распаду тропоколлагена. Тропоколлаген расщепляется на глютин, который хорошо набухает в воде при температуре 40°С и растворяется.
Глютин легко переваривается ферментами и образует студни. При дальнейшем нагревании и при повышенных температурах 95 – 100°С (120°С) под давлением глютин расщепляется до низкомолекулярных соединений: глютозы и желатозы, они понижают гидратацию студня и уменьшают его прочность.
Вывод. Характер изменения коллагена при тепловой обработке мясного сырья может существенно влиять на качество готовых изделий (изменение консистенции, водосвязывающей способности, перевариваемости пищи).
IV.2.4.4.2. Эластиновые волокна
Эластиновые волокна состоят из фибриллярного белка эластина. Полипептидные цепочки эластина не однородны и сформированы из молекул проэластина.
Проэластин имеет молекулярную массу 72×103 и в его состав входит 800 остатков аминокислот.
В состав эластина входят: глицин, аланин, лизин. Отсутствуют: триптофан, цистин. Мало метионина.
В эластине содержатся специфические аминокислоты, десмозины и изодесмозины (только в нем), они участвуют в образовании поперечных связей между цепочками эластиновых волокон. Эластин характеризуется тем, что он устойчив к действию кислот и щелочей.
В отличие от коллагена, эластин почти не изменяется при нагревании. На него очень медленно действует фермент пепсин при рН=2.
На эластин медленно воздействует фермент поджелудочной железы – эластаза.
IV.2.5. Влияние тепловой обработки на физико-химические свойства белков мяса
При денатурации белков очень важную роль играет вода. При тепловой обработке воду добавляют или она присутствует в достаточном количестве в самом продукте. Роль воды в денатурации глобулярных белков объясняется следующим образом: при повышении температуры молекулы воды приобретают дополнительную кинетическую энергию, проникают внутрь молекул белков, наносят много ударов по полипептидной цепочке. При этом складки полипептидных цепей глобулярных белков начинают отходить друг от друга. Сами молекулы белка находятся в движении, в результате разрушаются солевые, водородные, ионные связи. Глобула разворачивается, изменяя свою вторичную, третичную и четвертичную структуры, т.е. она денатурирует. В процессе развертывания полипептидных цепочек разорванные внутренние водородные связи нативного белка заменяются внешними водородными связями с водой. Это обусловливает разрыхление денатурированных глобул. Если условия денатурирования мягкие, то белки могут восстановить нативную форму. В жестких условиях восстановление исключено.
В зависимости от свойств нативного белка денатурация большинства глобулярных белков наступает при 50-60°С.
В жестких условиях (высокие температуры) идет процесс гидролиза ковалентных пептидных связей – деструкция, при этом образуются свободные аминокислоты.
Тепловая денатурация мышечных белков сопровождается изменением саркоплазматических белков, которые образуют сплошной гель, белки миофибрилл образуют коагель. При дальнейшем нагревании мяса происходит уплотнение белковых гелей с выделением питательных веществ. Размеры мышечных волокон уменьшаются на 36-42%. Усилие на разрез мышечного волокна возрастает. Потери массы при варке 38–40%.
Фибриллярные белки подвергаются денатурации. Эластин в горячей воде только набухает, коллаген подвергается более сложным изменениям с образованием студней. Важным фактором является продолжительность тепловой обработки. В коллагене под действием горячей воды происходят разрывы связей как внутри, так и между полипептидными цепочками. В коллагеновых волокнах под действием горячей воды проходит три стадии:
1. Разрываются водородные связи внутри полипептидных цепочек.
2. Разрываются боковые связи, которые удерживают полипептидные цепочки коллагена в компактном состоянии.
3. Разрываются водородные связи между карбоксильными группами коллагена и водой.
В результате из тройной спирали образуются двойные и одинарные спирали. При образовании этих спиралей происходит сокращение коллагеновых волокон. Этот процесс сокращения называется свариванием. При сваривании длина коллагеновых волокон иногда уменьшается в 3–4 раза. При длительной тепловой обработке разрываются межмолекулярные связи и коллаген распадается на глютин.
Температура дезагрегации коллагена начинается с 62°с. Процесс перехода коллагена в глютин изменяется в зависимости от pH: при понижении pH процесс ускоряется.
| Схема №3 Схема постденатурационных изменений белков | ||||||||||||
| Глобулярные | Белки | Фибриллярные | ||||||||||
| денатурация ¯ | ¯ денатурация | |||||||||||
| Продукты денатурации | Продукты денатурации | |||||||||||
| постденатурация ¯ | ¯ постденатурация | |||||||||||
| Свертывание (коагуляция) | Дезагрегация | |||||||||||
| ¯ | ¯ | ¯ | ¯ | ¯ | ||||||||
| Хлопья | Гель | Коагель | Аминокислоты | Желатозы | ||||||||
| Пептоны | Альбумозы | |||||||||||
IV.2.6. Белки рыбы и их изменения при кулинарной обработке
В мускулатуре рыб мышечные волокна располагаются параллельно.
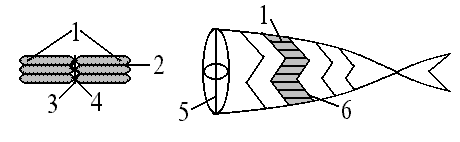
Рис.3. Строение мышечных волокон рыбы: 1 – мышечные волокна; 2 – миакома; 3 – соединительнотканная прослойка; 4 – кровеносные сосуды; 5 – продольная септа; 6 – поперечные септы
Миакомы – это объединение параллельных мышечных волокон.
Поперечные септы объединяют миакомы в мышцы.
Продольная септа объединяет две большие мышцы в целую тушку.
Продольные и поперечные септы состоят в основном из соединительно-тканных белков.
Мелкие септы между мышечными волокнами называются соединительно-тканными прослойками.
Мускулатура рыбы разных видов различается по содержанию: кета – 14–22%, сельдь – 14–21%, осетр – 13–16%, карась – до18% мышечных белков.
Отдельные виды рыбы превосходят по содержанию мышечных белков теплокровных животных.
Рыбу и нерыбное сырье подвергают всем видам тепловой обработки. Характер изменения в рыбе такой же, как в мясе: денатурация, дегидратация, деструкция.
Потеря массы рыбы (при варке) при тепловой обработке – 18–20%. Это происходит за счет потерь воды.
Белки рыбы и белки мяса изменяются в разной степени при одинаковых условиях теплообработки:
Замечено, что до70°С отделение воды у рыбы и у мяса возрастает, до 95°С мясо отделяет дополнительное количество влаги, а рыба прекращает выделение воды при 75°С.
Небольшие потери воды мышечной ткани рыб объясняются следующими причинами:
1.Особенностью химического состава мышечной ткани.
2. Особенностью гистологического строения.
3.Высокой концентрацией миозина в миофибриллах мышечной ткани.
4.Простое строение внутримышечной соединительной ткани.
5.Сравнительно низкая температура денатурации и дезагрегации коллагена соединительно-тканных прослоек.
6.Тепловая денатурация.
Вода, которая отделяется при денатурации поступает в пространство между пучками мышечных волокон, слабо выпрессовываясь. Слабое выпрессовывание идет потому, что в малой степени деформируются коллагеновые волокна соединительной ткани. Коллагеновые волокна при тепловой обработке подвергаются сравнительно быстрой деструкции (коллаген переходит в глютин). Поэтому мясо рыбы теряет не более 25% воды, оно сочное по сравнению с мясом убойных животных.
Исследование мышечных белков рыбы и подвержение кулинарной обработке показали, что белки претерпевают изменения:
1. Значительно уменьшается количество растворимых фибриллярных белков.
2. В 3–3,5 раза увеличивается количество денатурированных белков.
3. Значительно увеличивается количество водо-растворимых азотистых веществ, т.к. происходит желатинизация коллагена (образуется глютин, затем желатоза).
4. Незначительно уменьшается количество растворимых белков саркоплазмы.
ЛЕКЦИЯ № V
V.2.7. Белки молока и их изменения при кулинарной обработке
Молоко – это биологическая жидкость сложного состава, однако, все составные части в нем связаны между собой. Основную долю составляет вода (83–89%), которая образует дисперсионную среду. Питательные вещества находятся в молоке в различном физическом состоянии. Так, молочный сахар – лактоза (его содержание колеблется в пределах 4–5,5%) и минеральные соли (0,6–0,8%) образуют истинные растворы. Белковые вещества молока составляют 2,7–5% и распределяются в дисперсионной среде в виде отдельных молекул, но последние так велики по размерам, что образуют растворы, близкие по свойствам к коллоидным. Содержание жира в молоке колеблется в широких пределах – от 2,8 до 6% – и находится во взвешенном состоянии, образуя эмульсию или суспензию (в зависимости от температуры молока). В целом же молоко можно рассматривать как мало концентрированный золь, все составные части которого хорошо диспергированы и поэтому хорошо атакуются ферметами и легко усваиваются. Особенно легко заметить связь отдельных составных частей в молоке по его вкусу. Содержание лактозы в молоке составляет в среднем 4,7%. Если приготовить такой раствор, то его сладость будет ощущаться в значительно большей степени, чем это имеет место в натуральном молоке.
Содержание белковых веществ молока зависит от корма, времени лактации, породы и возраста скота и других факторов. Среднее содержание азотистых веществ – 3,3% и только 0,2% приходится на азотистые не белковые вещества.
Важнейшим белком молока является казеиноген, он составляет 80% всех белковых веществ молока. По своему химическому строению он относится к фосфопротеидам. Фосфорная кислота в казеиногене связана эфирной связью с аминокислотой серином. Питательная ценность казеиногена определяется высоким содержанием в нем незаменимых аминокислот, содержащихся в таком соотношении, которое приближает казеиноген к идеальному белку, фосфора и кальция. Он является поставщиком активного фосфора в организм. В молоке казеиноген находится в комплексе с кальцием, этот комплекс называется казеинкальцийфосфатным. Мицеллы казеиногена в молоке образуют устойчивую коллоидную систему благодаря тому, что частицы казеинкальцефосфатного комплекса связаны с водой своими гидрофильными функциональными группами (COOH, NH2). Стойкость комплекса может быть нарушена воздействием кислот (изоэлектрическая точка казеиногена рН=4,7), ферментов, добавочным введением солей кальция. При этом выделяется нерастворимый в воде казеин, который либо выпадает в осадок, либо образует гель. Казеиноген растворимый в воде переходит в казеин нерастворимый в воде. Химически чистый казеин представляет собой белое аморфное вещество без запаха и вкуса. Путем электрофореза казеин может быть разделен на 11 фракций, из которых изучены три (a-, b-, g-фракции), различающиеся молекулярным весом, элементарным составом и отношением к сычужному ферменту (аминокислотному составу, по степени перевариваемости). Казеин – амфотерный электролит, однако, кислотные свойства в нем преобладают.
Содержание альбумина в молоке составляет в среднем 0,4%. Он относится к сывороточным белкам, растворяется в воде, денатурирует при нагревании. При воздействии сычужного фермента не свертывается. Частицы альбумина гидратированы еще