ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТИ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ К ТЕПЛОЕМКОСТИ
ПРИ ПОСТОЯННОМ ОБЪЕМЕ
Цель работы: определить методом Клемана-Дезорма отношение теплоемкостей газа.
Оборудование: закрытый стеклянный баллон; U - образный манометр; поршневой насос.
Краткие теоретические сведения .
Теплоемкостью вещества называют количество тепла, которое необходимо сообщить телу, чтобы повысить его температуру на один кельвин.
Теплоемкость единицы массы вещества называют удельной теплоемкостью (Суд), а теплоемкость одного моля вещества - молярной теплоемкостью (С m).
Таким образом,

где Суд и С m - удельная и молярная теплоемкости,
dQ - количество сообщенного тепла,
dT - изменение температуры тела при нагревании,
m и m - масса вещества и масса моля этого вещества соответственно.
Величина теплоемкости газа сильно зависит от условий нагревания.
При изобарическом нагревании (P=const) подведенное к газу тепло расходуется на увеличение его внутренней энергии и на совершение работы:
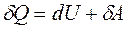 . (1)
. (1)
Изменение внутренней энергии идеального газа вычисляется по формуле:
 ,
,
где i - число степеней свободы молекул газа,
R - универсальная газовая постоянная (8,315 Дж/моль×К).
Элементарная работа газа при равновесном расширении:

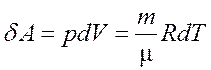 . (2)
. (2)
Таким образом,
 .
.
Из формул (1) и (2) получается выражение для молярной теплоемкости идеального газа при постоянном давлении:
 . (3)
. (3)
При изохорическом нагревании газа (V =const) его работа равна нулю (dA = pdV = 0), все подведенное тепло идет на приращение внутренней энергии газа (dQ = dU) и молярная теплоемкость
 . (4)
. (4)
Таким образом, теплоемкость идеального газа не зависит от температуры, a oпределяется только числом степеней свободы молекул газа и характером изменения состояния.
Из выражения (3) и (4) следует, что отношение теплоемкости Сp к теплоемкости СV:
 . (5)
. (5)
Величину g называют коэффициентом Пуассона, или показателем адиабаты.
Определение g важно потому, что эта величина входит в уравнения, описывающие адиабатические процессы, для которых dQ=0, и процессы, близкие к ним, такие, как распространение звука, течение газов со звуковыми и сверхзвуковыми скоростями и т. п.
Конечно, для однородного газа g легко рассчитать по формуле (5). Однако, для смеси газов расчет осложняется, так как нужно знать процентное содержание каждого газа в смеси. В этом случае удобнее g определять опытным путем.
В настоящей работе для определения g воздуха предлагается метод Клемана и Дезорма.
Описание установки и метода Клемана и Дезорма.
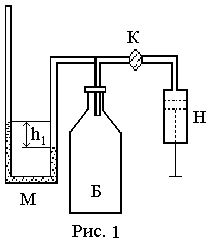 Установка состоит из стеклянного баллона Б, поршневого насоса Н, водяного манометра М, клапана-крана К рис.1. Роль клапана-крана на некоторых установках может выполнять резиновая трубка.
Установка состоит из стеклянного баллона Б, поршневого насоса Н, водяного манометра М, клапана-крана К рис.1. Роль клапана-крана на некоторых установках может выполнять резиновая трубка.
 |
Если при помощи насоса накачать в баллон некоторое количество воздуха, то его давление и температура повысятся. Вследствие теплообмена с окружающей средой температура воздуха в баллоне через некоторое время сравняется с температурой окружающей среды. Давление Р1, установившееся в баллоне, больше атмосферного на величину, определяемую разностью уровней h1 жидкости в коленах манометра (рис. 1). Р и h измеряются в мм водяного столба.
 Если обозначить через m массу воздуха в баллоне при атмосферном давлении, то при давлении
Если обозначить через m массу воздуха в баллоне при атмосферном давлении, то при давлении  воздух займет меньший объем, чем объем сосуда. Обозначим этот объем через
воздух займет меньший объем, чем объем сосуда. Обозначим этот объем через  . Тогда состояние воздуха массой m внутри баллона будет характеризоваться параметрами
. Тогда состояние воздуха массой m внутри баллона будет характеризоваться параметрами  ,
,  ,
,  .
.
На рис. 2 данному сoстоянию соответствует точка А.
Если открыть на короткое время кран К, то воздух в баллоне расширится. Давление внутри баллона в конце расширения сравняется с атмосферным (обозначим его через  , объем рассматриваемой массы воздуха равен объему сосуда
, объем рассматриваемой массы воздуха равен объему сосуда  . Так как процесс быстрого расширения воздуха можно считать адиабатическим, то температура газа
. Так как процесс быстрого расширения воздуха можно считать адиабатическим, то температура газа  станет ниже комнатной.
станет ниже комнатной.
Следовательно, в конце адиабатического расширения (точка Б на рис. 2) параметры газа будут 
Применяя к этому состоянию уравнение Пуассона, получим:
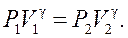 |
Охладившийся при расширении воздух в баллоне через некоторое время, вследствие теплообмена, нагреется до комнатной температуры (процесс нагревания является изохорическим). Поэтому давление воздуха возрастет до некоторой величины
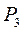 . Это давление будет больше атмосферного на величину, определяемую разностью уровней жидкости в коленах манометра
. Это давление будет больше атмосферного на величину, определяемую разностью уровней жидкости в коленах манометра 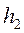 . Параметры этого состояния (точка Д на рис. 2):
. Параметры этого состояния (точка Д на рис. 2):
 .,
.,  .
.
На графике рис. 2 показаны процессы перехода газа из одного состояния в другое. Линия АБ является адиабатой, БД- изохорой, АД -изотермой.
Так как переход газа из состояния А в состояние Б происходит адиабатически, то он подчиняется уравнению Пуассона ( ), которое в данном случае удобно записать в форме
), которое в данном случае удобно записать в форме
 (6)
(6)
Дальнейший переход из состояния Б в состояние Д может быть охарактеризован уравнением Гей-Люссака (изохорический процесс):
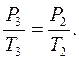 (7)
(7)
Исключив из уравнений (6) и (7) температуру и учтя, что  , получим
, получим
 (8)
(8)
Подставляя в (8) значения давлений Р1 и Р3, выраженные через давление Р2 и разность столбов жидкости в манометре (
 ), получим
), получим

В условиях эксперимента 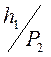 и
и  значительно меньше единицы, поэтому можно ограничиться лишь двумя первыми членами биномов Ньютона, что дает
значительно меньше единицы, поэтому можно ограничиться лишь двумя первыми членами биномов Ньютона, что дает

Отсюда можно получить расчетную формулу для коэффициента Пуассона:
 (9)
(9)
Порядок выполнения работы.
1. Проверить, нет ли утечки газа из баллона. Для этого с помощью поршневого насоса медленно нагнетают в баллон воздух. За повышением давления воздуха в баллоне наблюдают по разности уровней в коленах манометра. Так как при нагнетании воздуха температура его несколько повысится, следует подождать 2-3 минуты, пока установится тепловое равновесие с окружающей средой. После этого, если показания манометра не изменяются (нет утечки воздуха), записывают значение h1, соответствующее исходному состоянию (А).
2. Открыть клапан-кран (К), соединяя воздух в баллоне с атмосферой. Как только выровняется давление воздух внутри баллона с атмосферным (прекратится шипение воздуха), клапан-кран быстро закрыть, или при отсутствии клапана-крана пережать резиновую трубку.
Предполагается, что этот процесс соответствует адиабате АВ (рис.2). Давление воздуха в баллоне понизится до атмосферного, а газ охладится. Однако, в результате теплообмена с окружающей средой через 2-3 минуты после закрытия клапана-крана газ изохорически перейдет в состояние Д. Давление воздуха в баллоне возрастет и появится разность уровней h2 в коленах манометра. Указанный эксперимент повторить 5-6 раз. Результаты измерений h1 и h2 записать в табл. 1.
Таблица 1
| № п/п | h1i | h2i | g i | g i -<g> | (gi -<g>)2 |
| . | |||||
| . | |||||
| <g> | S(g i -<g>) | S(g i -<g>)2 | |||
3. По формуле (9) вычислить g i для каждого опыта.
4. Вычислить абсолютную и относительную погрешность по формуле:

5. Записать конечный результат в виде:
g = <g> ± Dg.
6. Рассчитать g теоретически, считая воздух двухатомным газом. Сравнить экспериментальный результат с теоретическим. Объяснить расхождение результатов.
Контрольные вопросы
1. Что называют удельной теплоемкостью и молярной теплоемкостью вещества? Какая связь между ними?
2. Теплоемкость - это функция состояния или функция процесса?
3. Чему равны молярные теплоемкости идеальных газов при изопроцессах?
4. Почему Ср>Cv? Каков физический смысл универсальной газовой постоянной R?
5. Какое практическое значение имеет соотношение 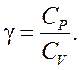
6. Какой процесс называется адиабатическим и каким уравнением он описывается?
7. Какова связь между параметрами, характеризующими состояние газа при адиабатическом процессе?
8. Изобразите график процессов, происходящих в данной работе, в координатах Р и V и назовите эти процессы. Изобразите графики известных вам процессов в координатах Р и Т, Т и V.
9. От каких параметров зависит внутренняя энергия идеального газа?
10. Как формулируется первое начало термодинамики и как оно записывается аналитически? Как записать его для различных изопроцессов?
11. Выведите расчетную формулу для вычисления g.
12. Почему необходимо выждать некоторое время после того, как накачают воздух в баллон?
13. Почему после выхода воздуха из баллона и перекрытия клапана-крана возникающая разность уровней в коленах манометра зависит от скорости (времени) расширения газа?
14. Каковы отличия между реальным и идеальным газами?