Практическая работа №2
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ
Цель работы: приобретение навыков приготовления растворов различной концентрации из сухой соли или более концентрированного раствора.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Растворы играют важную роль в живой и неживой природе, а также в науке и технике.
Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами.
Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации:
Массовая доля (w)– отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента cодержится в 100 г раствора.
Молярная концентрация (См)– отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения - моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5М.
Молярная концентрация эквивалента (Сн) – это отношение количества эквивалентов вещества (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, Сн(KOH)=1моль/л,
Сн(1/2H2SO4)=1моль/л, Сн(1/3AlCl3) =1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1н.
Титр (Т) – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см3.
Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду: мерные колбы, пипетки и бюретки.
Мерные колбы – тонкостенные плоскодонные сосуды с длинным узким горлом, на котором нанесена метка в виде кольцевой черты. На каждой колбе обозначены ее емкость и температура, при которой эта емкость измерена. Колба должна плотно закрываться пробкой (рис.1).
Пипетки используют для отбора определенного объема пробы жидкости.
Пипетки Мора представляют собой стеклянные трубки с расширением посередине. Нижний конец оттянут в капилляр, на верхнем конце нанесена метка, до которой следует набирать измеряемую жидкость. На пипетке указана объемность. Широко применяют также градуированные пипетки различной емкости, на наружной стенке которых нанесены деления. Для наполнения пипетки нижний конец ее опускают в жидкость и втягивают последнюю при помощи груши или специального приспособления. Жидкость набирают так, чтобы она поднялась на 2-3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем правой руки, придерживая в то же время пипетку большим и средним пальцами. Затем ослабляют нажим указательного пальца, в результате чего жидкость будет медленно вытекать из пипетки. В тот момент, когда нижний мениск (уровень) жидкости окажется на одном уровне с меткой, палец снова прижимают. Введя пипетку в сосуд, отнимают указательный палец и дают жидкости стечь по стенке сосуда. После того, как жидкость вытечет, пипетку держат еще 5секунд прислоненной к стенке сосуда, слегка поворачивая вокруг оси.
Бюретки применяют при титровании, для измерения точных объемов и т.д.

Рис. 1 Мерная посуда
а - мерная колба; б – пипетки; в – бюретка.
Объемные бюретки – это стеклянные трубки с несколько оттянутым нижним концом или снабженным краном. На наружной стенке по всей длине бюретки нанесены деления в 0,1 мл. К оттянутому концу бескрановой пипетки с помощью резиновой трубки закладывают стеклянную бусинку. Бюретку заполняют жидкостью через воронку. Затем открывают кран и зажим, чтобы заполнить раствором часть бюретки, расположенной ниже крана или зажима до нижнего конца капилляра. Бюретку заполняют так, чтобы вначале уровень жидкости был несколько выше нулевого деления шкалы. Затем, осторожно приоткрывая кран, устанавливают уровень жидкости на нулевое деление. Каждое титрование следует начинать только после заполнения бюретки до нуля.
Для менее точного измерения объемов жидкости используют мерные цилиндры и мензурки (рис.2)
Рис. 2 Мерные цилиндры и мензурка
Как известно, плотность - это масса вещества в единице объема, ρ = m/v. Зная плотность, можно по таблице определить массовую долю (%) раствора.
Определить плотность раствора можно многими способами. Из них наиболее простой и быстрый – с помощью ареометра (рис.3).
Его применение основано на том, что плавающее тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не станет, равна массе самого тела (закон Архимеда). В расширенной нижней части ареометра помещен груз, на узкой верхней части – шейке - нанесены деления, указывающие плотность жидкости, в которой плавает ареометр. Концентрацию исследуемого раствора находят, пользуясь табличными данными о плотности в зависимости от концентрации раствора. Плотность водных растворов хлорида натрия приведена в табл.1.
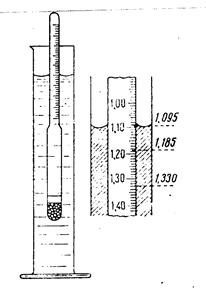
Рис. 3 Ареометр и отсчет по его шкале
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 1. Приготовление водного раствора хлорида натрия. определение массовой доли и расчет навески.
Выполнение опыта.
1)Получить навеску соли хлорида натрия у преподавателя.
2)При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл.
3)Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды.
4) Растворить соль в воде.
5) Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном.
6) Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз.
7) По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности.
8) Рассчитать количество хлорида натрия взятого для приготовления 250 мл раствора.
Таблица 1.Плотность и процентное содержание растворов хлорида натрия.

ПРИМЕР 1. Пусть плотность приготовленного раствора хлорида натрия ρ=1,0053г/см3. Это соответствует 1% концентрации раствора. Следовательно, в100г раствора содержится 1г NaCl. Определим массу 250 мл раствора
 г
г
Исходя из того, что в 100г раствора содержится 1г NaCl, узнаем, сколько грамм NaCl содержится в 201,315г раствора:
100 г раствора - 1 г NaCl
201,315 г раствора - х г NaCl
х =  г NaCl
г NaCl
Таким образом, была взята навеска NaCl массой 2,0131 г.