Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Выполнение опыта. Приготовить 250 мл 10 % раствора хлорида натрия, имея в своем распоряжении 15 % и 5 % раствор NaCl.
1)Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15 % и 5 % раствора (см. пример 2).
2)Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном.
3)Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.1 найти его концентрацию (в %).
4)Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн.
ПРИМЕР 2. Приготовить 100г 36% раствора H3PO4, смешав 44% и 24% растворы этой кислоты.
I СПОСОБ РАСЧЕТА:
Обозначим через х количество граммов 44% раствора, которое следует добавить к (100-х) граммам 24% раствора для получения 100г 36% раствора H3PO4. Составим уравнение:
0,44х+(100-х)0,24=100∙0,36, откуда

Следовательно, необходимо взять 60 г 44% раствора H3PO4 и 100 - х = 40г 24% раствора.
II СПОСОБ РАСЧЕТА: Он называется "правилом креста".
Если в левый угол воображаемого прямоугольника поместить более высокую концентрацию – 44, а в нижний левый – меньшую концентрацию –24, а в центре - концентрацию получаемого смешанного раствора – 36 и затем вычесть по диагонали из большего числа меньшее, то отношение разностей 12: 8 = 3: 2 покажет в каком весовом соотношении следует смешать исходные растворы для получения раствора заданной концентрации.
Так, для получения 100г 36% раствора достаточно смешать 60г 44% раствора и 40 г 24% раствора.

Определив по таблице плотности исходных растворов – 1,285 г/см3 (для 60% раствора) и 1,114 (для 40% раствора) находим, что объемы их соответственно составляют:
V = 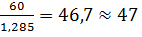 мл 44% раствора H3PO4
мл 44% раствора H3PO4
 мл 24% раствора H3PO4
мл 24% раствора H3PO4
ОПЫТ 3. приготовление раствора хлорида натрия с заданной массовой долей соли (%) разбавлением концентрированного раствора.
Выполнение опыта
1) В мерный цилиндр наливают имеющийся раствор хлорида натрия и ареометром определяют его плотность.
2) По таблице 1 находят концентрацию исходного раствора (в %).
3) Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора.
4) Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл.
5) Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой.
6) Раствор в колбе перемешивают.
7) Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе.
8) Проверить плотность и концентрацию полученного раствора.
9) Рассчитать относительную ошибку δотн
δотн = 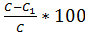 %, где с– заданная концентрация,
%, где с– заданная концентрация,
с1- полученная концентрация.
10) Сделайте расчет молярной концентрации, молярной концентрации эквивалента и титра, приготовленного раствора.
11) Результаты запишите в таблицу 2.
Таблица 2. Опытные данные

ПРИМЕР 3. Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3.
По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3.
Вычислим массы исходной кислоты и воды, требующиеся для получения заданного объема раствора.
Масса его составляет 500×1,14 = 570 г, а содержание в нем H2SO4 равно:
 г.
г.
Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4:
1 мл исходной кислоты содержит 1,84 × 0,96 г H2SO4
х мл исходной кислоты содержит 114 г H2SO4
 мл
мл
Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора.
Объем воды определяется как разность объемов исходного раствора и рассчитанного объема 96% кислоты, а именно:
V(Н2О)= 500мл - 64,6мл=435,4мл.